
【题目】海洋是“聚宝盆”,工业上,人们直接从海水中得到食盐。海水在浓缩过程中析出盐类物质的种类和质量,如下表:
海水密度(g/L) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | ||||
1.20 | 0.91 | ||||
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)常采用____________的方法从海水中得到食盐。
(2)为得到含杂质较少的食盐,实际生产中卤水的密度控制在_____之间。
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,通常在实验室中依次加入_________、__________、___________、___________等四种物质除去杂质。(填化学式)
(4)电解饱和食盐水可以制取氯气,同时得到几种重要的化工产品,
该反应的化学方程式为_________________________________________。通电时阳极产物是__________该产物的检验方法是___________________________________________
(5)电解过程中得到气体物质还可以化合为HCl,在实验室中我们利用_________________和_____________ 反应(写名称)来制取。该气体__________________溶于水,可以做喷泉实验。写出氯化氢气体溶于水后的电离方程式_____________________________________
(6)新制的氯水显_______色,这是因为氯水中有__________(填微粒符号)存在。向氯水中滴入几滴AgNO3溶液,观察到的现象是____________________________,发生变化的化学方程式为______________________________________________。蓝色石蕊试纸遇到氯水后的现象是___________________________,氯气有毒,不能直接排放到空气中,需要用________________________来吸收,写出反应的化学方程式为_________________________________________
【答案】蒸发结晶 1.21g/L-1.26g/L BaCl2 Ca(OH)2 Na2CO3 HCl 电解饱和食盐水2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 氯气 湿润的淀粉碘化钾试纸变蓝色 氯化钠 浓硫酸 极易 HCl→H++Cl- 淡黄绿色 Cl2 白色沉淀 Cl-+Ag=AgCl↓ 先变红,但很快又褪色 氢氧化钠 Cl2+2NaOH → NaCl+NaClO+H2O
2NaOH+H2↑+Cl2↑ 氯气 湿润的淀粉碘化钾试纸变蓝色 氯化钠 浓硫酸 极易 HCl→H++Cl- 淡黄绿色 Cl2 白色沉淀 Cl-+Ag=AgCl↓ 先变红,但很快又褪色 氢氧化钠 Cl2+2NaOH → NaCl+NaClO+H2O
【解析】
(1)依据氯化钠溶解度随温度变化不大,现代产盐常用太阳能蒸发法或盐田法,即蒸发结晶;
(2)根据表中析出氯化钠时海水最小密度及海水密度与其它杂质的含量关系进行判断;
(3)SO42-、Ca2+、Mg2+离子分别转化为硫酸钡、碳酸钙、氢氧化镁沉淀而除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的盐酸溶液.
(4)电解饱和食盐水可以制取氯气,同时得到氢气和氢氧化钠;通电时阳极氯离子被氧化,产物是氯气;可用湿润的淀粉碘化钾试纸检验;
(5)HCl沸点低,可用氯化钠固体和浓硫酸来制取,由于HCl极易溶于水,可用来做喷泉实验,在水中全电离。
(6)新制氯水中存在Cl2+H2O![]() H++Cl-+HClO,则溶液中存在Cl2、HClO、H+、Cl-、ClO-等粒子,结合对应粒子的性质解答该题.
H++Cl-+HClO,则溶液中存在Cl2、HClO、H+、Cl-、ClO-等粒子,结合对应粒子的性质解答该题.
(1)氯化钠溶解度随温度变化不大,蒸发溶剂的方法得当氯化钠晶体,现代产盐常用太阳能蒸发法或盐田法,即蒸发结晶;
(2)析出NaCl的最小卤水密度1.21g·L-1,且小于1.21g·L-1时有一定量的CaSO4析出;随着密度的增大NaCl析出量的变化,由于在密度1.21g·L-1~1.26 g·L-1之间NaCl已经大部分析出,当近一步浓缩时NaCl的析出量已经不多,而此时其他盐类的析出量在明显增加,这样会使食盐中杂质含量升高;所以控制在1.26 g·L-1以内,
故范围为:1.21-1.26;
(3)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、 Ca(OH)2 溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和 Ca(OH)2 溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后过滤后加入盐酸,所以正确顺序为:BaCl2、 Ca(OH)2 、Na2CO3、HCl;
(4)电解饱和食盐水可以制取氯气,同时得到氢气和氢氧化钠,方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;通电时阳极氯离子被氧化,产物是氯气;该产物的检验方法是:可用湿润的淀粉碘化钾试纸变蓝;
2NaOH+H2↑+Cl2↑;通电时阳极氯离子被氧化,产物是氯气;该产物的检验方法是:可用湿润的淀粉碘化钾试纸变蓝;
(5)HCl沸点低,可用氯化钠固体和浓硫酸来制取,由于HCl极易溶于水,可用来做喷泉实验,在水中全电离,电离方程式为 HCl=H++Cl-。
(6)新制氯水中存在Cl2+H2O![]() H++Cl-+HClO,因氯气可溶于水,新制的氯水显黄绿色,这是因为氯水中有Cl2分子,含有Cl-,向氯水中滴入几滴AgNO3溶液,观察到的现象是有白色沉淀生成,发生变化的化学方程式为Cl-+Ag=AgCl↓,溶液呈酸性,可使石蕊变红,但同时含有强氧化性的次氯酸,可氧化石蕊,则可观察到蓝色石蕊试纸遇到氯水后,首先变红,得很快又褪色,氯气有毒,不能直接排放到空气中,需要用氢氧化钠 来吸收,写出反应的化学方程式为 Cl2+2NaOH=NaCl+NaClO+H2O。
H++Cl-+HClO,因氯气可溶于水,新制的氯水显黄绿色,这是因为氯水中有Cl2分子,含有Cl-,向氯水中滴入几滴AgNO3溶液,观察到的现象是有白色沉淀生成,发生变化的化学方程式为Cl-+Ag=AgCl↓,溶液呈酸性,可使石蕊变红,但同时含有强氧化性的次氯酸,可氧化石蕊,则可观察到蓝色石蕊试纸遇到氯水后,首先变红,得很快又褪色,氯气有毒,不能直接排放到空气中,需要用氢氧化钠 来吸收,写出反应的化学方程式为 Cl2+2NaOH=NaCl+NaClO+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. AlN中氮的化合价为-3 B. 上述反应中,每消耗1 mol N2需转移3 mol电子
C. AlN的摩尔质量为41 g D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A.两者均有丁达尔现象
B.两者均能透过半透膜
C.加入盐酸先沉淀,随后溶解
D.分散质微粒可通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.蛋白质是热值最高的营养物质D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。
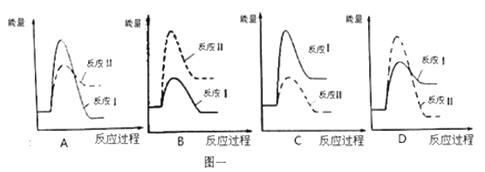
(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。
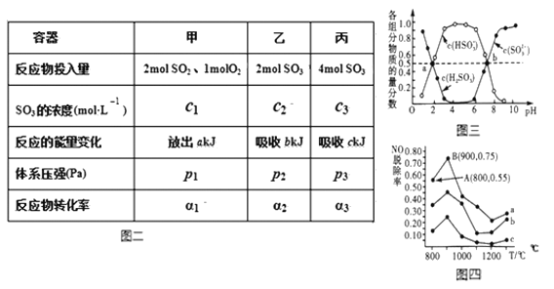
(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO![]() )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
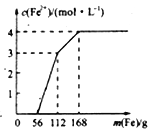
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是
A. CuCl2 [CuSO4] B. NaOH [NaOH] C. NaCl [HCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com