
| A. | 4 molA+2 molB | |
| B. | 4 mol C+1 molD+2mol A+1 mol B | |
| C. | 1.6mol C+0.3 molD+1.2mol A+0.6 mol B | |
| D. | 4 mol C+0.8molD |
分析 反应2A(g)+B(g)?4C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为w mol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol,n(B)=1mol即可,据此进行分析.
解答 解:A、开始加入4 molA+2 molB,假如容器的容积为原容器容积的2倍,则达到平衡时各组分的浓度与原平衡相等,C的浓度为w mol/L,然后将容器的容积缩小一半,相当于增大了压强,平衡向着逆向移动,则C的浓度小于2w mol/L,大于w mol/L,故A错误;
B、开始加入4 mol C+1 molD+2mol A+1 mol B,将4molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入4molA+2molB所到达的平衡,由A中分析可知,平衡时C的浓度小于2w mol/L,大于w mol/L,故B错误;
C、开始加入1.6mol C+0.3 molD+1.2mol A+0.6 mol B,将1.6mol C+0.3 molD按化学计量数转化到左边可得0.8molA、0.4molB,故等效为开始加入2molA、1molB所到达的平衡,与原平衡为等效平衡,平衡时C的浓度等于wmol/L,故C正确;
D、开始加入4 mol C+0.8molD,按化学计量数转化到左边可得1.6molA、0.8molB,则C的浓度小于w mol/L,故D错误.
故选:C.
点评 考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.


科目:高中化学 来源: 题型:选择题
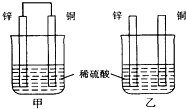
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的氢离子浓度均减小 | D. | 产生气泡的速度甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按X、Y、Z的顺序增大 | |
| B. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| C. | 元素的非金属性按X、Y、Z的顺序增强 | |
| D. | 气态氢化物稳定性按X、Y、Z的顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物仅含碳、氧两种元素 | |
| B. | 该有机物中碳、氧、氧原子个数比为1:4:2 | |
| C. | 无法确定是否含有氧元素 | |
| D. | 该有机物中一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使甲基橙溶液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应的发生都需要加热,放热反应在常温下一定容易发生 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com