
分析 (1)Al与氢氧化钠反应生成氢气,根据电子转移守恒计算Al的物质的量,再根据m=nM计算Al的质量,进而计算Mg的物质的量;
(2)Mg、Al均与硫酸反应,反应生成MgSO4、Al2(SO4)3,反应中硫酸根物质的量不变,由硫酸根离子守恒可知n(H2SO4)=n(MgSO4)+3n[Al2(SO4)3],进而计算硫酸的物质的量浓度.
解答 解:(1)Al与氢氧化钠反应生成氢气,氢气物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电子转移守恒,Al的物质的量为$\frac{0.3mol×2}{3}$=0.2mol,则Al的质量为0.2mol×27g/mol=5.4g,故Mg的物质的量为$\frac{7.8g-5.4g}{24g/mol}$=0.1mol,
答:合金中镁的物质的量为0.1 mol;
(2)Mg、Al均与硫酸反应,反应生成MgSO4、Al2(SO4)3,反应中硫酸根物质的量不变,由硫酸根离子守恒可知n(H2SO4)=n(MgSO4)+3n[Al2(SO4)3]=0.1mol+3×$\frac{0.2mol}{2}$=0.4mol,故原硫酸的物质的量浓度为$\frac{0.4mol}{0.5L}$=0.8mol/L,
答:原硫酸物质的量浓度为0.8mol/L.
点评 本题考查化学方程式计算、混合物计算,明确发生的反应即可解答,注意利用守恒法不能方程式的繁琐.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=ll的CH3COONa溶液中水电离出的OH-的数目为0.001NA | |
| B. | 28g乙烯和丙烯的混合气体含有的原子个数为3NA | |
| C. | 1 mol/L-l NaHCO3溶液中含有HCO3-数目小于NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 往CuCl2溶液中加入钠 2Na+Cu2+═2Na++Cu | |
| C. | 铁与稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、光导纤维都属于有机高分子材料 | |
| B. | 道尔顿、阿伏伽德罗、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中NO2-被还原 | |
| B. | 生成1mol NaNO3需消耗0.4mol KMnO4 | |
| C. | 反应过程中溶液的pH减小 | |
| D. | □中的粒子是OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
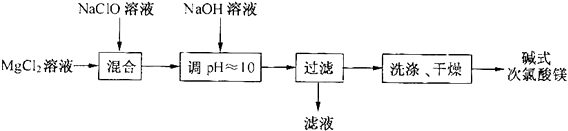
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com