
【题目】常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/LCH3COOH溶液和 HCN 溶液所得滴定曲线如图[Ka(CH3COOH)>Ka(HCN)]。下列说法正确的是
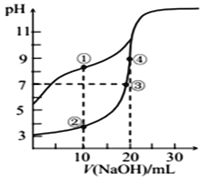
A.点①和点②所示溶液中:c(CH3COO﹣)<c(CN﹣)
B.点①和点②所示溶液中:c(CH3COO﹣)-c(CN﹣) = c(HCN)-c(CH3COOH)
C.溶液中水的电离程度:③>④
D.点③和点④所示溶液中都有:c(CH3COO﹣)+c(OH﹣) = c(CH3COOH)+c(H+)
【答案】B
【解析】
A. 根据图知,0.10 molL1的CH3COOH溶液和HCN溶液的pH:CH3COOH<HCN,所以两种酸中c(H+):CH3COOH>HCN,酸性CH3COOH>HCN,酸根离子水解程度:CH3COO<CN,则点①和点②所示溶液中。c(CH3COO)>c(CN),故A错误;
B. ①②点溶液中加入的酸的物质的量相等,且溶液体积相等,根据物料守恒得c(CH3COO)+c(CH3COOH) = c(CN)+c(HCN),所以得c(CH3COO)-c(CN)=c(HCN)-c(CH3COOH),故B正确;
C. 点③呈中性,溶质为CH3COOH和CH3COONa,水解程度和酸电离程度相等,点④溶质CH3COONa,单一水解,因此水的电离程度为④>③,故C错误;
D. 点③溶质为CH3COOH和CH3COONa,根据电荷守恒得c(CH3COO)+c(OH) = c(Na+)+c(H+),溶液呈中性,因此有c(CH3COO) = c(Na+),无法得出c(CH3COO)+c(OH) = c(CH3COOH)+c(H+),点④溶质CH3COONa,根据电荷守恒得c(CH3COO)+c(OH) = c(Na+)+c(H+),根据物料守恒得到c(CH3COO)+ c(CH3COOH) = c(Na+),无法得出c(CH3COO)+c(OH) = c(CH3COOH)+c(H+),故D错误。
综上所述,答案为B。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】已知1,2-二氯乙烷在常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂;乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置。请回答下列问题:

(1)为了检查整套装置的气密性,某同学将导气管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是_______________。
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入______,目的是______,并向装置C中试管里加入适量稀溴水。
(3)为了使反应在75 ℃左右进行,常用的方法是_______________________________。
(4)与装置A中大试管相连接的长玻璃管的作用是______,装置B的作用是______。
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是______,装置A、C中发生反应的化学方程式分别为_________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
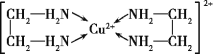
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
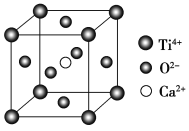
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是短周期原子序数依次增大的主族元素,X原子最外层电子数是电子层数的2倍,Z为地壳中含量最高的元素,R的单质是短周期最活泼的金属。由W、X、Y三种元素组成的化合物甲的球棍模型如图,甲是运载火箭的燃料之一。下列说法正确的是
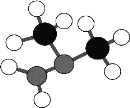
A.化合物甲分子中每个原子都达8电子的稳定结构
B.W、Y、Z三种元素可形成离子化合物
C.Y与Z只能形成2种二元化合物
D.简单离子半径:R > Z > Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有烃的衍生物A,还原A时形成醇B,氧化A时形成酸C。B、C反应可生成高分子化合物![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A.A属于醛类,其相对分子质量为58,1 mol A与足量的银氨溶液反应可生成4 mol Ag
B.B在一定条件下可通过缩聚反应得到新的高聚物
C.高分子化合物![]() 的组成与B、C等物质的量的混合物的组成相同
的组成与B、C等物质的量的混合物的组成相同
D.B、C生成该高聚物的反应为缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或折开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为

A.-1 638 kJ/molB.+1 638 kJ/molC.-126 kJ/molD.+126 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子晶体是由原子直接通过共价键形成的空间网状结构的晶体,又称共价晶体,因其具有高熔沸点、硬度大、耐磨等优良特性而具有广泛的用途。
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含_____个Si原子,在晶体硅的空间网状结构中最小环为_____元环,每最小环独立含有__________个Si原子,含1molSi原子的晶体硅中Si-Si键的数目为_____。
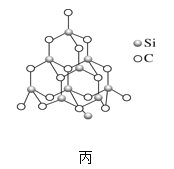
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:
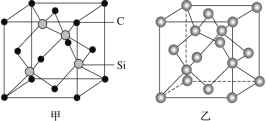
①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是_____(均用化学式表示)。
②在金刚砂的结构中,一个碳原子周围结合了_____硅个原子,其键角是_____。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有_个C-Si键
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为_____;若金刚砂的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为_________pm(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
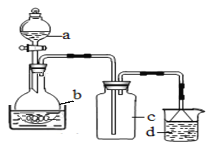
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
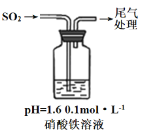
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求书写
![]() 系统命名是________________________________
系统命名是________________________________
2—甲基—1,3-丁二烯的结构简式 __________________________________
(2)下列各对物质中属于同系物的是___________________,属于同分异构体的是____________属于同位素的是__________,属于同素异形体的是___________
A ![]() C与
C与![]() C B O2与O3
C B O2与O3
C  D
D 
E  与
与
(3)下列属于苯的同系物的是____________________(填字母)。
A  B
B ![]() C
C ![]() D
D 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com