
分析 化学方程式为14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O,反应中硝酸表现为酸性和氧化性,结合化合价的变化判断转移电子的数目,结合反应的方程式计算.
解答 解:(1)由于NO3-+4H++3e-═NO↑+2H2O是还原过程,需要加入还原剂才能发生,而KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中具有较强还原性的只有Cu2O,且Cu2O被氧化生成Cu2+,化学方程式为14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O,
故答案为:14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O;
(2)硝酸在反应中分别生成硝酸铜和NO,则体现了酸性和氧化性,故答案为:酸性;氧化性;
(3)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,则硝酸的还原产物的价态应比NO中氮元素的价态高,依据浓硝酸反应的规律知,应是使用了较浓的硝酸,产物中有部分NO2生成,故答案为:使用了较浓的硝酸,产物中有部分NO2生成.
点评 本题考查氧化还原反应的相关计算,题目难度不大,注意根据物质的性质判断反应物和生成物书写反应的化学方程式是解答该题的关键.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaHCO3溶液中:K+、Cl-、AlO2-、SO42- | |
| B. | 加入铝粉能产生H2的溶液中:Na+、Fe3+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:SO32-、NO3-、K+ | |
| D. | 含有大量MnO4-的溶液中:H+、Ca2+、K+、Cl-、C2O42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
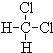 和
和 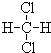
 与
与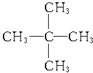
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
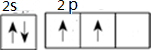
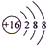 .A+、C2-、D-中离子半径最小的是Na+.
.A+、C2-、D-中离子半径最小的是Na+.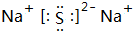 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.01×105Pa,20℃时48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com