
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
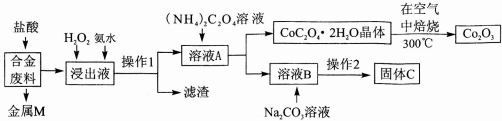
分析 合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O4•2H2O足量空气煅烧得到氧化钴;
(2)加入H2O2的作用是氧化亚铁离子为铁离子;加入氨水的作用是调节溶液PH使Fe3+转化为Fe(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤,90℃时c(Li2CO3)的浓度为0.10mol/L,则c(Li+)=0.20mol/L,c(CO32-)=0.10mol/L,则Ksp(Li2CO3)=0.20×0.20×0.10=4.0×10-3;
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,应为二氧化碳和氧气.
解答 解:合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子转化为氢氧化铁沉淀,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O4•2H2O足量空气煅烧得到氧化钴,
(1)上述分析判断金属M为Cu,操作Ⅰ为过滤操作,故答案为:Cu;过滤;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是调节溶液PH使Fe3+转化为Fe(OH)3沉淀,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液的pH使Fe3+转化为Fe(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水,反应的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2,
故答案为:4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤,90℃时c(Li2CO3)的浓度为0.10mol/L,则c(Li+)=0.20mol/L,c(CO32-)=0.10mol/L,则Ksp(Li2CO3)=0.20×0.20×0.10=4.0×10-3,
故答案为:减少Li2CO3的溶解损失;4.0×10-3;
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,应为二氧化碳和氧气,电极方程式为2CO32--4e-=O2↑+2CO2↑,故答案为:2CO32--4e-=O2↑+2CO2↑.
点评 本题主要考查物质的分离提纯的综合应用,为高频考点,侧重于学生的分析能力和实验能力、计算能力的考查,综合性强,注意把握实验的流程和原理,难度较大.


科目:高中化学 来源: 题型:填空题
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应Al-3e-Al3+ | B. | 燃料气体是氧气 | ||
| C. | 正极反应为2CO2+O2+4e-2CO32- | D. | 该电池不能用烃类物质作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A. | 该系统中不只存在化学能和电能的相互转化 | |
| B. | 在移位反应器中,反应CO(g)+H2O(g)?CO2(g)+H2(g)(△H>0),若温度越高,则v(CO)越大 | |
| C. | 改质器和移位反应器的作用是将CxHy转化为H2和CO2 | |
| D. | 该电池正极的电极反应为O2+4H+-4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液加AgNO3溶液,观察是否产生淡黄色沉淀,检验CH3CH2Br与NaOH溶液是否发生反应 | |
| B. | 在实验室,将乙醇和浓硫酸的混合物共热发生反应,生成能使酸性KMnO4溶液褪色的气体,此气体一定是乙烯 | |
| C. | 室温下向苯和少量苯酚的混合液中加入适量烧碱溶液,振荡、静置后分液,可除去其中的苯酚 | |
| D. | 将硝酸银溶液和少量乙醛于试管中充分混合后,把试管放在热水浴中加热,在试管内壁上有光亮的银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com