
| A�� | �����¶ȿ��Լӿ췴Ӧ���� | |
| B�� | �ﵽ��ѧ��Ӧ��ʱ������2mol NH3 | |
| C�� | 1mol N2 ��3mol H2������������2mol NH3�������� | |
| D�� | ���������ټ���N2�ɼӿ�����Ӧ���� |
���� A�����»�ѧ��Ӧ���ʼ�����
B�����淴Ӧ�ķ�Ӧ�ﲻ����ȫת����
C����Ӧ���ȣ�˵����Ӧ���������������
D������Ũ�ȣ���Ӧ���ʼӿ죮
��� �⣺A�����»�ѧ��Ӧ���ʼ�������A����
B���ϳɰ��ǿ��淴Ӧ�����淴Ӧ�ķ�Ӧ�ﲻ����ȫת��Ϊ���������1mol N2��3mol H2������Ӧ���ɵİ�������2mol����B����
C����Ӧ���ȣ�˵��1mol N2��3mol H2������������2mol NH3������������C����
D������Ũ�ȣ���Ӧ���ʼӿ죬�����һ�����ܱ��������ټ��� N2��Ӧ���ʼӿ죬��D��ȷ��
��ѡD��
���� ���⿼����Ӱ�컯ѧ��Ӧ���ʵ����ء����淴Ӧ���ص㡢��Ӧ�ʱ��뷴Ӧ��������������ϵ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܢڢۢ٢� | B�� | �ޢ� | C�� | �ڢ٢� | D�� | �ޢߢ٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
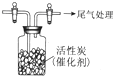 ijѧϰС���Ʋ�SO2����ǿ������Cl2��Ӧ����SO2Cl2��Ϊ�˽���̽����
ijѧϰС���Ʋ�SO2����ǿ������Cl2��Ӧ����SO2Cl2��Ϊ�˽���̽�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ��X-ǿ��Y2- | |
| B�� | X�ĺ���������Ա�Y�ĺ����������ǿ | |
| C�� | X�ĵ���X2�ܽ�Y��������Y2-�������������û���Ӧ | |
| D�� | X���⻯���Y���⻯��е�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | N-H | N-N | O=O | N��N | H-O |
| ����/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A�� | 1088 kJ•mol-1 | B�� | 544 kJ•mol-1 | C�� | 790 kJ•mol-1 | D�� | 382 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KCl | B�� | CaCl2 | C�� | MgO | D�� | Na2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������̼�ĵ���ʽ��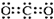 | B�� | 14C��ԭ�ӽṹʾ��ͼ�� | ||
| C�� | C3H8�ĽṹʽCH3-CH2-CH3 | D�� | ������ĵ���ʽ��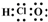 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
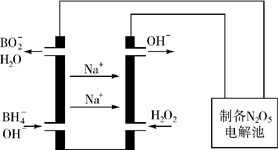 ������Ҫ�������簱���£�N2H4����NO��NO2��HNO3�������εȣ��������������о�����Ҫ���ã�
������Ҫ�������簱���£�N2H4����NO��NO2��HNO3�������εȣ��������������о�����Ҫ���ã�| 0.01mol•L-1����Һ | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com