
| A. | a+8-m-n | B. | a+16-m-n | C. | a-8-(m+n) | D. | a-(m+n) |
分析 已知A、B两元素的原子序数在3~18之间,它们可形成离子化合物,则A为活泼金属,B为活泼非金属,举例进行判断,得出正确结论.
解答 解:A.若AmBn为MgCl2,则a=12,m=1,n=2,则B的原子序数为12+8-1-2=17,故A可能;
B.若AmBn为BeCl2,则a=4,m=1,n=2,则B的原子序数为4+16-1-2=17,故BC可能;
C.若金属离子在同周期,离子的核外电子数目相差8,则a-n+8=x+m,即x=a+8-m-n,故C不可能;
D.若AmBn为Na2O,则a=11,m=2,n=1,则B的原子序数为11-2-1=8,故D可能,
故选C.
点评 本题考查根据化学式判断化合物中原子序数的数量关系,难度中等.根据题意举出实例是解题的关键.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.20 | 0.60 | 0 |
| 10 | a1 | a2 | 0.25 |
| 13 | b1 | 0.45 | b2 |
| 15 | d1 | d2 | 0.30 |
| A. | 前10 min内的平均反应速率v(Y)=2.5×10-3 mol/(L•min) | |
| B. | 保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10-3 mol/L | |
| C. | 若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50% | |
| D. | 若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
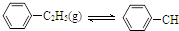 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3-CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方案 | 实验步骤 | 实验现象 | 结论 | 有关反应的化学方程式 |
| 1 | 取少量待测溶液,向其中滴加适量BaCl2溶液 | |||
| 2 | 猜想②正确 | 无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com