
| A. | 菜刀切咸肉后未处理而生锈 | B. | 用食醋除去水壶中的水垢 | ||
| C. | 用葡萄自酿葡萄酒 | D. | 将黄瓜切成片 |
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2S和PH3含有相同的原子数 | |
| B. | NH3的摩尔质量为17 | |
| C. | 9.03×1023个CO2分子的质量为66g | |
| D. | 同温同压下,相同体积的物质,其物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
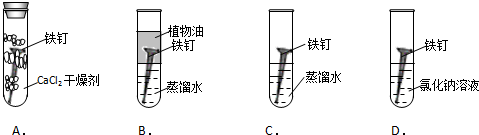
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
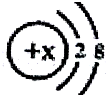 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
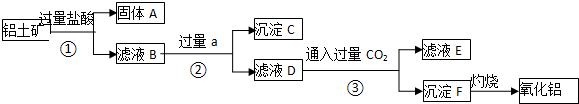
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
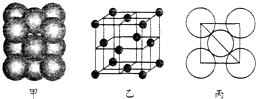
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com