
| 元 素 | Mn | Fe | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
分析 (1)根据不同原子间化学键的类型判断[Al(OH)4]-中共存在的化学键类型;
(2)分子中共用电子对偏向于电负性大的原子,偏离于电负性小的原子;
(3)原子轨道处于半满、全满、全空时能量更低稳定;
(4)离子晶体的晶格能越大,离子晶体熔点越高,晶格能由离子的电荷和离子半径决定;
(5)氢键影响物质的沸点和溶解性,含有氢键的物质沸点较高、溶解性较强.
解答 解:(1)光谱证实单质Al与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为极性共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,所以,[Al(OH)4]-中存在极性共价键、配位键、δ键,
故答案为:acd;
(2)元素的电负性越大,其吸引电子能力越大,根据元素吸引电子能力知,这三种元素电负性大小顺序是C>H>Si;
故答案为:C>H>Si;
(3)由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定;
(4)离子晶体的晶格能越大,离子晶体熔点越高,MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以MgO熔点高;
故答案为:>;MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以MgO熔点高;
(5)O元素非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,硫元素和水分子间不能形成氢键,所以H2O2的沸点比H2S高,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键.
点评 本题是对物质结构与性质的考查,涉及化学键、电负性、晶体性质、氢键等,题目难度中等,是对知识与能力综合考查,注意把握原子稳定性与电子填充的关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
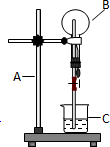 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com