
| A、Al跟NaOH溶液共热 |
| B、Al(NO3)3跟过量的NaOH溶液 |
| C、A12O3和水共热 |
| D、A12(SO4)3和过量的NH3?H2O |


科目:高中化学 来源: 题型:
| 样品序号 | 取样深度(m) | 有机质(×10-2g) | 总铬(×10-6g) |
| 样品A-1 | 0.00~0.30 | 2.81 | 114 |
| 样品A-2 | 0.30~0.60 | 1.72 | 111 |
| 样品A-3 | 1.20~1.80 | 1.00 | 88 |
| 样品B-1 | 0.00~0.30 | 2.60 | 116 |
| 样品B-2 | 0.30~0.60 | 2.48 | 112 |
| 样品B-3 | 1.20~1.80 | 1.83 | 106 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3、Al2O3 |
| B、Fe2O3 |
| C、Fe (OH)2、Al (OH)3 |
| D、Fe (OH)3、Al (OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )| A、镁铝合金的质量为0.39 g |
| B、盐酸的物质的量浓度为2mol/L |
| C、B点沉淀的质量 0.39g |
| D、镁铝与盐酸恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
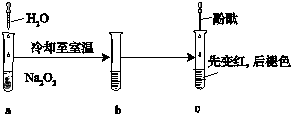 某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.
某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 | |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 … | ② … | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时,NaOH和H2O2共同作用使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2和Na2CO3 |
| B、稀盐酸和K2CO3 |
| C、Ba(OH)2和NaHCO3 |
| D、AgNO3和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①与②混合,所得混合溶液的pH=3 |
| B、②和③混合后,溶液呈酸性 |
| C、③和④分别用②中和,消耗②的体积:③>④ |
| D、若将四种溶液稀释100倍,溶液pH大小顺序:③>④>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com