

 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是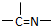 是分子的骨架,一个
是分子的骨架,一个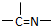 就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2;
就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2; 

 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
 向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:
向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1molA 1molB | 0.5molA 0.5molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充人0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 |
| B、配制稀盐酸定容时,俯视容量瓶刻度线 |
| C、滴定前尖嘴处无气泡,滴定终点时有气泡 |
| D、滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com