
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y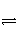
 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
下列关于教材中的各项说法错误的一项是( )
A.在化学反应中,反应物转化为生成物的同时,必然发生能量的变化
B.氮肥包括铵态氮肥、硝态氮肥和尿素
C.在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强
D.医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
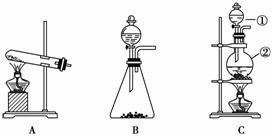
(1)选用A装置可制取的气体有________,选用B装置可制取的气体有________,选用C装置可制取的气体有________。
(2)标号①、②的仪器名称分别为________、________。
(3)写出利用上述有关药品制取氨气的化学方程式:______________________。若要制得干燥氨气,可选用下列干燥剂中的________(填序号)。
a.生石灰 b.浓硫酸 c.五氧化二磷
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)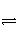
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________________,K值大小与温度的关系:温度升高,K值__________________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850 ℃时发生如下反应:
CO(g)+H2O(g)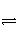
 CO2(g)+H2(g)+Q(Q>0)
CO2(g)+H2(g)+Q(Q>0)
CO和H2O浓度变化如图所示: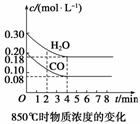
则0~4 min间平均反应速率v(CO)=________mol·L-1·min-1。
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下所示。
t℃时物质浓度(mol·L-1)的变化
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3~4 min之间反应处于________状态;c1数值________0.08 mol·L-1(填“大于”、“小于”或“等于”)。
②反应在4~5 min间,平衡向逆方向移动,可能的原因是________(单选)。表中5~6 min之间数值发生变化,可能的原因是________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增大氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)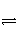
 I
I (aq)。上述平衡体系中,I
(aq)。上述平衡体系中,I 的物质的量浓度[I
的物质的量浓度[I ]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
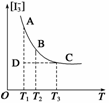
(1)通过分析图象,该反应的正反应为__________反应(填“吸热”或“放热”)。
(2)在T1、D状态时,v正______v逆(填“>”、“<”或“=”)。若在T1时某状态c(I-)/c(I )=1/100__________平衡状态(填“是”、“不是”或“不一定是”)。
)=1/100__________平衡状态(填“是”、“不是”或“不一定是”)。
(3)写出该平衡常数的表达式K=________________。若升高温度,K值将________(填“增大”、“减小”或“不变”,下同);若向溶液中加入少量的溴水,K值将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在预防SARS时,医学专家告诉我们对公共场所要进行消毒;毛巾、口罩要经常用开水蒸煮;被褥要放在太阳底下直射,其目的是( )
A.使蛋白质变性 B.使多糖水解
C.使油脂水解 D.使氨基酸变性
查看答案和解析>>
科目:高中化学 来源: 题型:
对牛奶中的蛋白质进行下列实验:取30.0 mL牛奶,用盖尔达法分离蛋白质,把氮完全转化为氨,用50.0 mL 0.5 mol·L-1 H2SO4溶液吸收后,剩余的酸用1 mol·L-1 NaOH溶液中和,需38.0 mL。
(1)30.0 mL牛奶中含有多少克氮?
(2)如果蛋白质中含氮16%(质量分数),计算牛奶中含蛋白质的质量分数。(已知牛奶的密度是1.03 g·mL-1)
提示:盖尔达法:蛋白质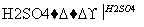 硫酸铵
硫酸铵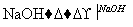 氨
氨
查看答案和解析>>
科目:高中化学 来源: 题型:
人们对酸碱的认识已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿伦尼乌斯(Arrhenius)提出的电离理论。
探究过程:
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿伦尼乌斯以水为溶剂的个别现象推广到任何溶液,提出了酸碱溶剂理论。溶剂理论认为凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨弱电离的方程式(生成的两种微粒电子数相等):________________________________________________________________________。
(2)1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列微粒在水溶液中既可看作酸又可看作碱的是________。
A.H2O B.NH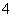 C.OH- D.HCO
C.OH- D.HCO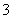 E.CH3COO- F.Cl-
E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + - —→ H:OH
试指出下列两个反应中的酸或碱:
①H3BO3+H2OH++B(OH)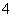 该反应中的碱是________;
该反应中的碱是________;
②NaH+H2O===NaOH+H2↑ 该反应中的酸是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com