
分析 (1)重金属盐可使蛋白质变性,而铵盐、钠盐、钾盐等可使蛋白质盐析;
(2)油脂可水解生成高级脂肪酸和甘油;
(3)氨基酸含有氨基和羧基,具有两性;
(4)葡萄糖为单糖,在人体内氧化生成二氧化碳和水,释放能量.
解答 解:(1)饱和(NH4)2SO4溶液可使蛋白质发生盐析,故答案为:盐析;
(2)油脂在酶的作用下水解生成高级脂肪酸和甘油,故答案为:高级脂肪酸和甘油;
(3)氨基酸含有氨基和羧基,具有两性,氨基酸可与盐酸反应,故答案为:氨基;羧基;能;
(4)葡萄糖为单糖,在人体内氧化生成二氧化碳和水,释放能量,反应的化学方程式为:C6H12O6+6O2$\stackrel{酶}{→}$6CO2+6H2O,
故答案为:单;放出;C6H12O6+6O2$\stackrel{酶}{→}$6CO2+6H2O.
点评 本题综合考查有机物的结构和性质,侧重于糖类、油脂、蛋白质的考查,为高频考点,注意把握相关物质的性质以及应用,题目有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
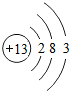 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑. ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
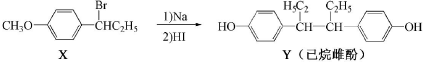
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 该反应为消去反应 | |
| D. | 化合物X中肯定有9个C原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
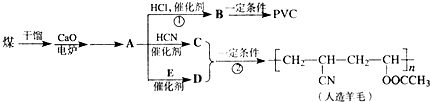
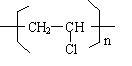 ,CH2C═CH-CN.
,CH2C═CH-CN.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 取用金属钠、钾时,未用完的钠、钾应放回原瓶 | |
| D. | 读取量筒内液体的体积,俯视读数会导致读数偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操 作 | 现 象 |
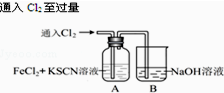 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
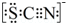 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com