
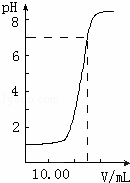
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
|
| A. | 盐酸起始浓度为0.1mol•L﹣1 |
|
| B. | NaOH溶液浓度为0.08mol•L﹣1 |
|
| C. | 滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色 |
|
| D. | 滴到中和点时,耗NaOH物质的量为0.002mol |
考点:
酸碱混合时的定性判断及有关ph的计算.
专题:
电离平衡与溶液的pH专题;化学实验基本操作.
分析:
由图象可知未加入NaOH溶液时盐酸pH=1,盐酸起始浓度为0.1mol•L﹣1,当加入NaOH25mL时,二者恰好完全反应,根据20×10﹣3L×0.1mol•L﹣1=25×10﹣3L×c(NaOH),可计算NaOH浓度,结合酸碱反应的实质可解答该题.
解答:
解:A.当V(NaOH)=0时,pH=1,则盐酸起始浓度为0.1mol•L﹣1,故A正确;
B.当加入NaOH25mL时,二者恰好完全反应,则有20×10﹣3L×0.1mol•L﹣1=25×10﹣3L×c(NaOH),c(NaOH)=0.081mol•L﹣1,故B正确;
C.滴入碱量为20mL时,酸过量,反应后c(H+)=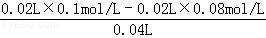 =0.01mol/L,pH=2,向混合溶液中滴入2滴甲基橙试液,溶液显红色,故C错误;
=0.01mol/L,pH=2,向混合溶液中滴入2滴甲基橙试液,溶液显红色,故C错误;
D.n(HCl)=20×10﹣3L×0.1mol•L﹣1=0.002mol,则滴到中和点时,耗NaOH物质的量为0.002mol,故D正确.
故选C.
点评:
本题考查酸碱混合的计算和判断,题目难度中等,本题注意正确判断并分析图象,为解答该题的关键.


科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1 160kJ•mol﹣1若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列叙述正确的是()
A. 22.4 L CO与N2的混合气体中所含原子总数为2NA
B. 已知2SO2(g)+O2(g)⇌2SO3(g)△H=﹣a kJ•mol﹣1,若将2NA个SO2与NA个O2混合充分反应放出a kJ的热量
C. 1 mol CO2分子中共价键总数为2NA
D. 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH﹣数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
|
| A. | 生成了一种强酸弱碱盐 |
|
| B. | 弱酸溶液和强碱溶液反应 |
|
| C. | 强酸溶液和弱碱溶液反应 |
|
| D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol.
② 和 两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣) D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3•H2O),混合后溶液中c(NH4+)与c(Cl﹣)的关系c(NH4+) c(Cl﹣).
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
|
| A. | NH4H的电子式为 |
|
| B. | NH4Cl的电子式为 |
|
| C. | NH4H含有极性共价键和离子键 |
|
| D. | NH4H固体投入少量热水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
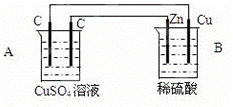
如图装置中,已知A、B两池溶液的体积均为200mL:
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,电极反应式为 ;A池中总反应化学方程式为 4 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L.工作一段时间后取出电极,测得导线上通过了0.04mol e﹣.则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 可利用过滤的方法区别溶液和胶体
B. 制备Fe(OH)3胶体通常是将Fe(OH)3固体溶于沸水
C. 直径介于1nm~100nm之间的微粒称为胶体
D. 电泳现象证明胶体粒子是带电的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com