
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | ﹣4,+4 | ﹣2 | ﹣1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为 ;R在元素周期表中的位置是 .
(2)Z的单质与水反应的化学方程式是↑ .
(3)Y与R相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是 .
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
X、Y、Z、M、R、Q是短周期主族元素,X元素的阳离子核外无电子,则X为氢元素;Y元素有﹣4、+4价,处于ⅣA族,是无机非金属材料的主角,则Y为Si元素;Z元素焰色反应呈黄色,则Z为Na元素;R元素有+7、﹣1价,则R为Cl元素;M元素有﹣2价,处于ⅥA族,原子半径小于Cl原子,故R为氧元素;Q有+3价,处于ⅢA族,原子半径大于Cl原子,则Q为Al元素,据此解答.
解答:
解:X、Y、Z、M、R、Q是短周期主族元素,X元素的阳离子核外无电子,则X为氢元素;Y元素有﹣4、+4价,处于ⅣA族,是无机非金属材料的主角,则Y为Si元素;Z元素焰色反应呈黄色,则Z为Na元素;R元素有+7、﹣1价,则R为Cl元素;M元素有﹣2价,处于ⅥA族,原子半径小于Cl原子,故R为氧元素;Q有+3价,处于ⅢA族,原子半径大于Cl原子,则Q为Al元素,
(1)Cl在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素;Cl元素原子有3个电子层.最外层电子数为7,处于周期表中第三周期ⅦA族,
故答案为:同位素;第三周期ⅦA族;
(2)Na与水反应生成氢氧化钠与氢气,反应化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)同周期自左而右非金属性增强,故非金属性Cl>Si,
a.物质的聚集状态属于物理性质,不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,稳定性HCl>SiH4,说明非金属性Cl>Si,故b正确;
c.Si与Cl形成的化合物中Si呈正价,说明Cl吸引电子的能力强,Cl元素的非金属性更强,故c正确;
故答案为:Cl;bc;
(4)同周期自左而右原子半径减小,故原子半径Cl<Si<Al,故Si的原子半径的最小范围是大于0.099nm小于0.143nm,
故答案为:大于0.099nm小于0.143nm.
点评:
本题考查结构性质位置关系、元素周期律等,难度不大,利用原子半径及化合价来推断出元素是解答本题的关键.


科目:高中化学 来源: 题型:
X、Y、Z、W、E为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.E原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJ•mol﹣1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)E元素基态原子的价电子排布式是: ,周期表中位置 ;
(2)X、Y、Z、W四种元素的电负性大小关系: (填元素符号,用“>”连接);
(3)写出W2Y2的电子式 ;
(4)X、Z可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;
(5)X的氢化物易溶于水的原因是:
(6)用氢键表示式写出Z的氢化物水溶液中可能存在的氢键 .
(7)肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号中为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂(足量) | 分离方法 | |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 乙酸(乙醛) | 新制Cu(OH)2 | 过滤 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液加入铝可以生成氢气,则在该溶液中可能大量存在的离子组是( )
|
| A. | K+、NH4+、NO3﹣、Cl﹣ | B. | Na+、K+、NH4+、Cl﹣ |
|
| C. | NH4+、K+、HCO3﹣、Cl﹣ | D. | Na+、Cu2+、Br﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径和主要化合价见表,下列有关说法中,正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、﹣2 | +7、﹣1 | +2 | ﹣2 |
|
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 |
|
| B. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 |
|
| C. | Z的氢化物的稳定性强于L的氢化物的稳定性 |
|
| D. | 与稀盐酸反应的剧烈程度:M单质<X单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g)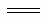 2 NO2(g) ΔH = +67.7kJ/mol
2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) 3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O
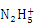 + OH-
+ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e- + 4OH- N2 + 4H2O
N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ.电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
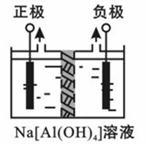
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e-时,将制得__________mol的Al(OH)3。
Ⅱ.制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的结构简式为: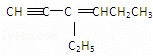 ,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
|
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中与物质化学性质无关的是( )
A. 用铂丝蘸取Na2CO3溶液在酒精灯焰上灼烧,观察到黄色火焰
B. 明矾可用作净水剂
C. 木条蘸取浓硫酸后变黑色
D. 用水(滴加了酚酞试液)和氨气做喷泉实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com