
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |


科目:高中化学 来源: 题型:
| A、a>b>c>d |
| B、b>a>d>c |
| C、c>d>b>a |
| D、d>c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2和稀硫酸反应:H++OH-=H2O |
| B、碳酸钡与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| C、澄清石灰水跟盐酸:H++OH-=H2O |
| D、硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
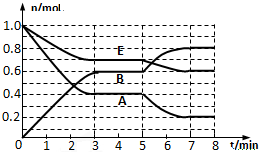 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol O3 和11.2L O2的体积一定相等 |
| B、5.6 gFe与足量的稀盐酸充分反应后,转移的电子数为0.2NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、1L 0.1mol/L的醋酸溶液中H+数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+) | ||
B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
| ||
| C、实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L | ||
| D、实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com