
| X | Y | Z | |
| 第一电离能(KJ/mol) | 520.2 | 495.8 | 418.8 |
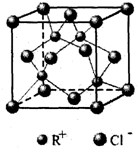


科目:高中化学 来源: 题型:
| A、23g NO2和N2O4的混合气体中含有的氮原子数为0.5nA |
| B、4.2g丙烯中所含的共价键数目为0.6nA |
| C、1L 0.1mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2nA |
| D、过氧化氢分解制得标准状况下1.12L O2,转移电子数目为 0.2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.5mol/L FeCl3溶液中含Fe3+的数目为0.5NA |
| B、34g10%的双氧水中,含有的共价键数目为3NA |
| C、氯化钠晶体中一个钠离子周围距离最近的氯离子的数目为6个 |
| D、用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
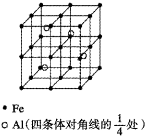 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
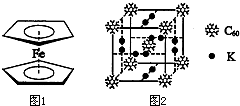
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
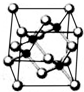 [化学一物质结构与性质]
[化学一物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1mol甲基(-CH3)所含电子数为7NA |
| B、0.4 mol以任意比例混合的乙炔和乙醛气体充分燃烧时,消耗氧气分子数为NA |
| C、常温常压下,NA个甲烷分子的体积大于22.4 L |
| D、1 mol Na2O2与水反应,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3a% |
| B、(100-2a)% |
| C、20% |
| D、1-3a% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com