
| A. | 11H2和21H2 | B. | H2O和D2O | C. | 235U 和 238U | D. | O2和O3 |
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 沼气是一种清洁的能源 | |
| B. | 使用沼气做能源是解决农村能源的主要途径 | |
| C. | 使用沼气给农民的生活带来了不便 | |
| D. | 使用沼气是对化学能的充分利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是化学变化 | B. | 没有能量变化 | ||
| C. | 有C-C、C-H键的断裂 | D. | 有C-C、C-H键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| B | 检验CH3CH2Br消去反应后的气体产物 | 水 | KMnO4溶液 |
| C | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
| D | 验证醋酸、碳酸、硅酸酸性强弱 | NaOH溶液 | Na2SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- |
| A. | 在pH<4的溶液中,碳钢主要发生析氢腐蚀 | |
| B. | 在pH>6的溶液中,碳钢主要发生吸氧腐蚀 | |
| C. | 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-═2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
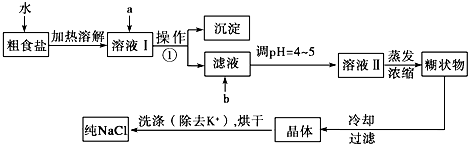
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
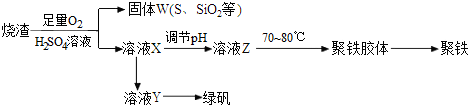

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com