

| 实验编号 | c(NaOH)mol/L | V(NaOH)mL | V(强酸)mL |
| 1 | 0.1154 | 25.72 | 25.09 |
| 2 | 0.1154 | 26.70 | 25.00 |
| 3 | 0.1154 | 26.79 | 25.09 |
| 4 | 0.1154 | 26.71 | 25.00 |
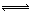 Ca2+(aq)+CO32?(ag)
Ca2+(aq)+CO32?(ag)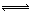 Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。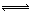 Ca2+(aq)+CO32?(ag)
Ca2+(aq)+CO32?(ag)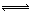 Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。

科目:高中化学 来源:不详 题型:单选题
| A.无论是纯水还是稀溶液,在室温下其[H+]?[OH-]=1×10-14mol2?L-2 |
| B.[H+]等于1×10-7mol/L的溶液一定是中性溶液 |
| C.0.2mol/LCH3COOH溶液中的[H+]是0.1mol/LCH3COOH溶液中的[H+]的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2?L-2 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)=2c(HS-)+c(S2-)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C.c(Na+)> c(S2-)>c(OH-)>c(HS-) |
| D.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
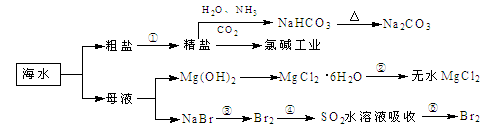
| A.过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH>c(CH3COO-) )>c(H+) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com