
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3
(1)△H3=__________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应Ⅰ。下列描述能说明反应Ⅰ达到平衡状态的是_____________(填序号).
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应Ⅱ在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:

此时,v正_________v逆 (填“>”、“<”或“=”),当反应达到平衡时,混合气体中CH3OH体积分数(CH3OH)%=_________%。
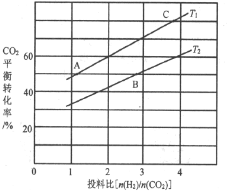
(4)反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;平衡常数K=_____(保留小数点后一位);KA、KB、KC三者之间的由大到小关系为______。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=![]() ×100%
×100%
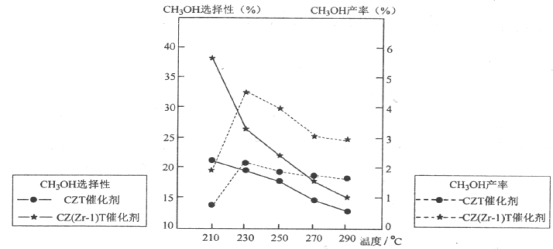
①温度高于230°C,CH3OH产率随温度升高而下降的原因是_______________。(答一条即可)
②在上述条件下合成甲醇的工业条件是___________________。
A.210°C B.230°C C.催化剂CZT D.催化剂CZ(Zr-1)T
【答案】-122.6 AC > 20 0.18mol·L1·min1 263.7 KA=KC>KB 反应I的△H<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率下降; BD
【解析】
(1)根据盖斯定律可知,反应Ⅰ×2-反应ⅠⅠ=反应ⅠⅠⅠ,故△H3=[(-49.6)×2-23.4] kJ/mol=-122.6 kJ/mol,
故答案为:-122.6;
(2)反应Ⅰ正向为气体体积减小的放热反应,
A、恒温恒容条件下,气体物质的量之比等于其压强之比,该反应正向气体物质的量减小,当容器内总压不变时,气体物质的量不变,可说明反应达到平衡状态,故A符合题意;
B、该反应为全气体反应,反应过程中气体质量不变,反应是在恒容容器中进行,故气体密度始终不变,则不能判断反应是否达到平衡状态,故B不符合题意;
C、水分子中断裂2NA个H-O键,即消耗1mol水,同时氢分子中断裂3NA个H-H键,即消耗3mol氢气,反应方向不同,物质消耗之比等于其计量数之比,说明正逆反应速率相等,故可说明反应达到平衡状态,故C符合题意;
D、CH3OH和H2O均为生成物,二者系数均为1,起始浓度均为0,故任意时刻二者的浓度之比均不变,故无法说明反应达到平衡状态,
故答案为AC;
(3)该时刻的浓度熵Qc=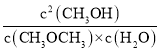 =
=![]() =
=![]() <0.25,故该反应正向进行,故v正>v逆;设从该时刻至平衡时,H2O(g)转化浓度为xmol/L,则
<0.25,故该反应正向进行,故v正>v逆;设从该时刻至平衡时,H2O(g)转化浓度为xmol/L,则
CH3OCH3(g)+H2O(g)![]() 2CH3OH(g)
2CH3OH(g)
起始(mol/L) 1.8 1.8 0.4
转化(mol/L) x x 2x
平衡(mol/L) 1.8-x 1.8-x 0.4+2x
由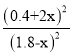 =0.25可解得x=0.2,n总=4mol,混合气体中CH3OH体积分数(CH3OH)%=
=0.25可解得x=0.2,n总=4mol,混合气体中CH3OH体积分数(CH3OH)%=![]() ×100%=20%,
×100%=20%,
故答案为:>;20;
(4)由图象可知,在T1温度下,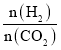 =2时,CO2平衡转化率为60%,在5min后反应处于平衡状态,故0~5min内
=2时,CO2平衡转化率为60%,在5min后反应处于平衡状态,故0~5min内![]() =
=![]() =1.8mol/L,则
=1.8mol/L,则![]() =0.9mol/L,故0~5min内的平均反应速率v(CH3OCH3)=
=0.9mol/L,故0~5min内的平均反应速率v(CH3OCH3)=![]() =
=![]() = 0.18mol·L1·min1;根据转化量之比等于其其系数之比可知,平衡时,c(CO2)=1.2mol/L、c(H2)=0.6mol/L、c(CH3OCH3)=0.9mol/L、c(H2O)=2.7mol/L,则K=
= 0.18mol·L1·min1;根据转化量之比等于其其系数之比可知,平衡时,c(CO2)=1.2mol/L、c(H2)=0.6mol/L、c(CH3OCH3)=0.9mol/L、c(H2O)=2.7mol/L,则K=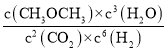 =
=![]() =263.7;相同投料比下达到平衡时,CO2平衡转化率T1>T2,故T1温度下的平衡常数大于T2温度下平衡常数,根据温度不变,平衡常数不变可知,KA=KC>KB,
=263.7;相同投料比下达到平衡时,CO2平衡转化率T1>T2,故T1温度下的平衡常数大于T2温度下平衡常数,根据温度不变,平衡常数不变可知,KA=KC>KB,
故答案为:0.18mol·L1·min1;263.7;KA=KC>KB;
(5)①由图象可知,在230℃之前,反应还未达到平衡状态,在230℃之后,反应达到平衡状态,而反应I正向为放热反应,升高温度,平衡逆向移动,使CH3OH产率下降,
故答案为:反应I的△H<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率下降;
②由图象可知,合成甲醇最佳条件为230℃下,在230℃下CZT催化剂对甲醇的选择性低于CZ(Zr-1)T催化剂,由此可知,最佳催化剂为CZ(Zr-1)T催化剂,
故答案为:BD。


科目:高中化学 来源: 题型:
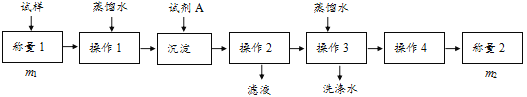
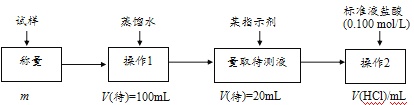
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二:
方法四:不使用化学试剂,使用实验室常用仪器。
(1)方法一:加入足量的试剂A___(填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、___、洗涤和干燥;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒外,还需要的用到的是___,在操作2中应选择甲基橙指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为___[用流程图中的数据m、V(HCl)填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是___;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是___,偏低的原因可能是___(均文字简述);
(6)方法四的实验原理是:___(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组研究采用BMED 膜堆(示意图如右),模拟精制浓海水为原料直接制备酸碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知: 在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法错误的是( )
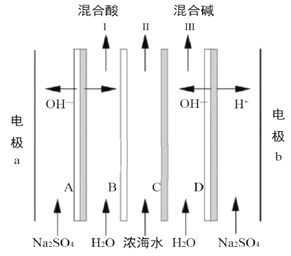
A. 电极a连接电源的正极 B. B为阳离子交换膜
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. Ⅱ排出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如表:
O=O | H—H | H—O(g) | |
键能/(kJ·mol-1) | 496 | 436 | x |
则表中x为
A.920B.557C.463D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是

A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名导演陈晓卿执导的纪录片《风味人间》中第一集中介绍了一种川西地区的民间美食-灰水煮笋,这里的“灰水”即指加了草木灰的水。草木灰中富含K2CO3(还有少量的KCl和K2SO4),某兴趣小组打算从“灰水”中提取KCl,请你帮他们完成以下工作。
(1)检验“灰水”溶液中的SO42______________________________________________________________________。
(2)检验“灰水”溶液中的CO32。
①小组内有同学认为,往上层澄清溶液中滴入Ca(OH)2溶液观察白色沉淀产生即可证明其中含有CO32。你认为此方案是否正确?__________(填“正确”或“错误”),理由是__________________________________________________________。
②小组内另一同学认为,应往澄清溶液中加入过量稀盐酸,通过______的现象判断CO32-的存在。写出加入过量盐酸反应的离子方程式__________________________。
(3)经过充分讨论后,小组内同学共同设计出了下面的分离提纯路线:

①“混合物1”经过一系列操作最终得到KCl固体,下列操作顺序合理的是______。
a、加入过量K2CO3溶液 B、加入过量稀盐酸 C、过滤 D、蒸发结晶
A、a→b→c→d B、a→c→b→d
C、b→c→a→d D、c→a→b→d
②实验室中,蒸发结晶操作应在___________(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为____________。

(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______mL上述浓盐酸进行配制,确定溶液体积的容器是________(填名称)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.实验前,容量瓶中有少量蒸馏水.___________。
b.用量筒量取浓盐酸时俯视观察凹液面.__________。
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.__________。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取______mL盐酸.
②假设该同学用新配制的盐酸中和含0.4gNaOH的溶液,发现比①中所求体积偏小,则可能的原因是________________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增。A原子核内仅有1个质子,B原子的电子总数与D原子的最外层电子数相等,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,D原子的最外层电子数是次外层电子数的3倍。
(1)请写出这四种元素元素名称:A_____;B_____;C_____;D_____。
(2)A与C形成常见化合物的化学式是_____,该化合物的水溶液呈_____性。
(3)B与D形成的化合物能溶于水,且与水反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的盐酸滴定20 mL约0.1 mol·L-1的氨水,滴定曲线如图所示,下列说法正确的是( )
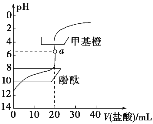
A.a点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
B.滴定过程中,当溶液pH=7时,二者恰好中和
C.用酚酞作指示剂比用甲基橙作指示剂滴定误差更小
D.当滴入盐酸为30mL时,溶液中:c(H+)+c(NH4+)<c(OH-)+c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com