

| A. | 海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等 | |
| B. | 步骤②中体现了溴易挥发的性质 | |
| C. | ①-④目的是为了富集溴元素 | |
| D. | 步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42- |
分析 由分离流程可知,浓缩海水中溴离子的浓度较大,①中与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl,以此来解答.
A.海水淡化海水就是将海水中的可溶性杂质除去的过程,淡化方法有海水冻结法、电渗析法、蒸馏法、反渗透法\离子交换法等,其中最常用的有蒸馏法、渗析法,海水淡化时使水与盐类物质分离;
B.溴单质易挥发;
C.用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴;
D.步骤③反应是二氧化硫具有还原性还原溴单质,发生反应为Br2+2H2O+SO2═2HBr+H2SO4,HBr是强电解质完全电离;
解答 解:A.蒸馏法、电渗析法、离子交换法等是海水淡化的主要方法,故A正确;
B.溴单质易挥发,用热的空气可以吹出,故B正确;
C.步骤①-④,先生成溴单质,热空气吹出溴单质后,用二氧化硫还原后再用氯气氧化的目的是富集溴元素,故C正确;
D.步骤③反应是二氧化硫具有还原性还原溴单质,反应的离子方程式为Br2+SO2+2H2O═2Br-+4H++SO42-,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握分离流程中的反应、混合物分离方法为解答本题的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ②⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积变大,c(H+)变大,呈酸性 | B. | 水的离子积不变,c(H+)不变,呈中性 | ||
| C. | 水的离子积变小,c(H+)变小,呈碱性 | D. | 水的离子积变大,c(H+)变大,呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  不能使酸性高锰酸钾溶液褪色 | |
| B. |  可与溴水发生取代反应而使溴水褪色 | |
| C. |  中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. |  在浓硫酸作用下可与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 | B. | Na2SO4 | C. | Na2CO3 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用热分解法冶炼氧化汞得到水银 | |
| B. | 从自然界中提炼金属要经过矿石的富集、冶炼、精炼三步 | |
| C. | 铝热法炼铁的反应需要高温的条件,所以是吸热反应 | |
| D. | 金属单质被发现和应用得越早,其活动性一般越弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
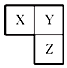 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )| A. | 在三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高 | |
| B. | Z元素的氧化物对应的水化物一定是一种强酸 | |
| C. | 三种元素原子半径的大小顺序为:X>Y>Z | |
| D. | Z的单质与Fe反应生成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | Y的简单气态氢化物的沸点高于同族相邻元素的简单气态氢化物 | |
| B. | Z与X形成的化合物,既能溶于盐酸又能溶于氨水 | |
| C. | W与Y元素形成的化合物既含离子键又含共价键 | |
| D. | X和Y的单质常温下就很容易发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com