
在T ℃下,某反应达到平衡,平衡常数K=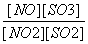 。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温下减小压强,反应体系的颜色加深
C.升高温度,逆反应速率减小
D.该反应化学方程式为NO2+SO2 NO+SO3
NO+SO3
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
反应:L(s)+aG(g)⇌bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )

|
| A. | 上述反应是放热反应 | B. | a=b |
|
| C. | a>b | D. | 上述反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。
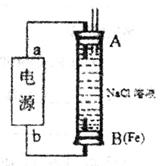
(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是_____。
a.电镀时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A.氯化钠 B.氢氧化钾 C.硫酸 D.硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种溶液:
①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液相同条件下,有关上述溶液的比较中,正确的是( )
A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种说法中,正确的是( )
A.电离时生成的阳离子全部是氢离子的化合物一定是酸
B.所有的盐电离时只能生成酸根阴离子和金属阳离子。
C.氧化物是指含有氧元素的化合物,如NaOH、H2SO4等。
D.氨气溶于水溶液显碱性,所以氨气属于碱
查看答案和解析>>
科目:高中化学 来源: 题型:
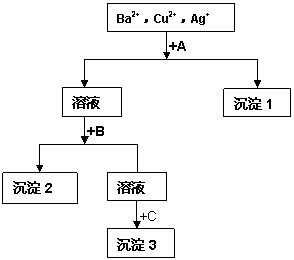
某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用
盐酸、NaOH溶液和Na2SO4溶液将溶液中三
种阳离子逐一沉淀分离, 其流程如右图所示。
下列说法不正确的是( )
A.试剂A只能为盐酸溶液
B.沉淀2可能是BaSO4 也可能是Cu(OH)2
C. 每加一种试剂需过量且要过滤后方可进行下一步
D.生成沉淀1的离子方程式可能为:
Cu2+ + 2OH- = Cu(OH)2↓
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com