
【题目】下图是实验室制取NH3的气体发生装置,请结合所学知识,回答下列问题:
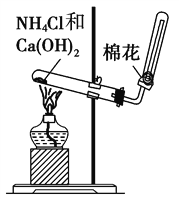
(1)图中用于加热的仪器名称是__________,收集的方法是________________法,验证是否已经收集满的方法是______________________________(任写一种)。
(2)写出实验室制取NH3的化学方程式:________________________________________。
(3)若有5.35 g氯化铵参加反应,则产生的在标准状况下的体积为________L。
【答案】 酒精灯 向下排空气 用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 2.24L
CaCl2+2NH3↑+2H2O 2.24L
【解析】试题分析:(1)用于加热的仪器是酒精灯,根据氨气易溶于水、密度小于空气选择收集方法,氨气能使湿润的红色石蕊试纸变蓝。
(2)实验室用氯化铵和氢氧化钙加热制取NH3。
(3)根据化学方程式计算氨气标准状况下的体积。
解析:(1)用于加热的仪器是酒精灯,氨气易溶于水、密度小于空气所以用向下排空气法收集,氨气能使湿润的红色石蕊试纸变蓝,验证是否已经收集满的方法是用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶。
(2)实验室用氯化铵和氢氧化钙加热制取NH3,方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 。
CaCl2+2NH3↑+2H2O 。
(3)设生成氨气标准状况下的体积vL;
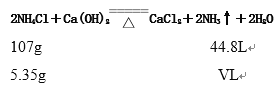
![]() v= 2.24L
v= 2.24L


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质与其用途的关系不正确的是( )
A.过氧化钠:供氧剂 B.碱石灰:干燥剂
C.小苏打:发酵粉主要成分 D.纯碱:治疗胃酸过多的一种药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时,焰色反应为黄色,则下列判断不正确的是( )
A.该物质可能是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠 D.不能确定该物质中是否含有钾元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
M | |
T |
请回答下列问题:
(1)T离子的结构示意图为__________,元素W在周期表中位于第______族,M单质分子的电子式为__________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)__________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)__________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三个体积相等的密闭容器中都进行如下反应:
CO2(g)+H2 (g)![]() CO(g)+H2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲:[H2]=[CO2]=amol 乙:[CO2]=amol [H2]=2amol 丙[CO2]=[H2]=[H2O]=amol,达到平衡时,CO的浓度由大到小的顺序排列正确的是
CO(g)+H2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲:[H2]=[CO2]=amol 乙:[CO2]=amol [H2]=2amol 丙[CO2]=[H2]=[H2O]=amol,达到平衡时,CO的浓度由大到小的顺序排列正确的是
A、丙>甲>乙 B、甲>乙>丙 C、乙>丙>甲 D、乙>甲>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnCl4是一种重要的工业原料,常作媒染剂等。已知SnCl4常温下是无色液体,在潮湿空气中易水解,熔点-36℃,沸点114℃。工业上制备SnCl4的工艺流程如下:
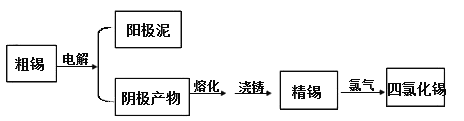
请回答下列问题:
(1)粗锡电解精炼时,常用硅氟酸(化学式为H2SiF6)和硅氟酸亚锡(化学式为SnSiF6)为电解液。已知H2SiF6为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为______。硅氟酸有腐蚀性,能与SiO2反应。电解时可选取下列电解槽中的________。
a.玻璃电解槽 b.不锈钢电解槽 c.塑料电解槽
阴极发生的电极反应式为_________。
(2)某同学模拟工业制法设计了由Sn与Cl2反应制取SnCl4的实验装置如下:
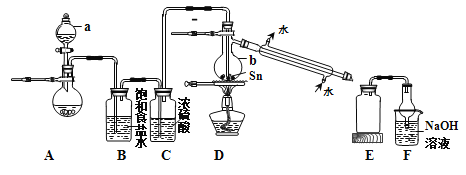
①a中浓盐酸与烧瓶内固体反应生成Cl2,则烧瓶内固体可以选用_________;仪器b的名称为_________。
②装置D的主要缺点是___________;除此之外,整套装置还有的缺点是_______。
③SnCl4溶液中加入适量的NaOH溶液,产生白色沉淀(二元酸),再加过量的NaOH溶液,白色沉淀溶解。试写出反应生成白色沉淀的离子方程式_________。
④若实验中取用锡粉5.95 g,反应后,E中广口瓶里收集到12.0 g SnCl4。则SnCl4的产率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com