
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:

(1)②的元素符号是__________;该元素的最高价氧化物的电子式为__________;
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤________⑥(填“>”或“<”);
(3)①和③两种元素组成的化合物中含有的化学键为__________(填“离子键”或“共价键”)
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为______________。
【答案】C ![]() < 共价键 Cl+Ag+=AgCl↓
< 共价键 Cl+Ag+=AgCl↓
【解析】
根据元素在周期表中的位置,①~⑥对应的元素分别是H、C、O、Na、S、Cl;
(1) 根据元素在周期表中的位置,②是碳元素,元素符号是C;C元素的最高价氧化物是CO2,CO2的电子式为![]() ;
;
(2)⑤是S元素、⑥是Cl元素,同周期元素从左到右非金属性增强,两种元素的非金属性强弱关系是:S<Cl;
(3)非金属元素之间易形成共价键,①是H元素、③是O元素,两种元素组成的化合物H2O或H2O2中含有的化学键为共价键;
(4)④是Na元素、⑥是Cl元素,两种元素组成的化合物是NaCl,NaCl与AgNO3溶液反应生成氯化银沉淀和硝酸钠,反应的离子方程式为Cl+Ag+=AgCl↓。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
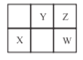
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰![]() ,硫氰
,硫氰![]() 等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:
等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:![]() ,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
A.![]() 浓
浓![]()
![]()
![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为![]() +CH3COOH
+CH3COOH +H2O
+H2O
实验参数
名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
实验装置如图所示(部分仪器及夹持装置已略去)。
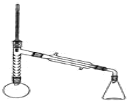
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105℃左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率;
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105℃左右的原因是______________。
(3)步骤1加热可用_____________(填“水浴”或“油浴”)。
(4)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗B.用少量热水洗
C.先用冷水洗,再用热水洗D.用酒精洗
(5)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(6)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:
O3+Cl===ClO+O2 ΔH1
ClO+O===Cl+O2 ΔH2
大气臭氧层的分解反应是:O3+O===2O2 ΔH,该反应的能量变化如图:
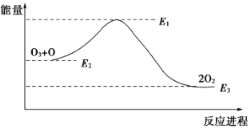
下列叙述中,正确的是
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com