
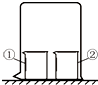
 用图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测现象 |
| A | 酚酞溶液 | 浓氨水 | ①中无色变红色 |
| B | CCl4 | 液溴 | ①中变橙色 |
| C | 浓氨水 | 浓硫酸 | 空气中产生白烟 |
| D | NaAlO2溶液 | 浓盐酸 | ①中有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓氨水易挥发,氨气易溶于水;
B.液溴易挥发出溴蒸气,溴蒸气易溶于四氯化碳;
C.浓氨水易挥发,浓硫酸难挥发;
D.浓盐酸易挥发,挥发出的少量的氯化氢与偏铝酸钠溶液反应生成氢氧化铝沉淀.
解答 解:A.浓氨水易挥发,氨气易溶于水与水反应生成一水合氨,一水合氨为碱,遇到酚酞变红色,故A正确;
B.②中挥发出的溴蒸气,易溶于①中的四氯化碳,溶液显橙色,故B正确;
C.浓氨水易挥发,浓硫酸难挥发,挥发的氨气被浓硫酸吸收,不会产生白烟,故C错误;
D.浓盐酸易挥发,挥发出的少量的氯化氢与偏铝酸钠溶液反应生成氢氧化铝沉淀,故D正确;
故选:C.
点评 本题考查了实验方案的评价,明确物质的性质是解题关键,注意浓氨水与挥发性酸才能产生大量白烟,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B |
| C | D |
| A. | 原子半径:C>A=D>B | |
| B. | 最高价氧化物对应的水化物酸性:B>D | |
| C. | 气态氢化物的稳定性:C>D>B | |
| D. | C的气态氢化物的水溶液在空气中放置会出现浑浊现象,可以说明非金属性A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
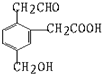 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
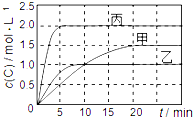 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强氧化性和脱水性 | B. | 强氧化性和吸水性 | ||
| C. | 难挥发性和酸性 | D. | 脱水性和吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | NH4Cl | C. | NH4NO3 | D. | (NH4)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com