
| A. | 第三周期非金属元素的含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从上到下依次减弱 | |
| C. | 在ⅥA族元素的氢化物(H2R)中,沸点最高的一定是无毒的 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点也一定越高 |
分析 A.同一周期,由左到右,得电子能力逐渐增强,非金属性增强,则第三周期非金属元素最高价含氧酸的酸性依次增强;
B.同一主族,由上到下,得电子能力逐渐减弱,非金属性减弱;
C.ⅥA族中,O的非金属性最强,且水中含氢键,沸点最高为水;
D.碱金属中原子半径越大,熔点越低,而卤素单质中原子半径越大,熔点越高.
解答 解:A、同一周期,由左到右,得电子能力逐渐增强,非金属性增强,则第三周期非金属元素最高价含氧酸的酸性依次增强,非金属元素含氧酸的酸性不一定为最高价含氧酸,故A错误;
B、同一主族,由上到下,得电子能力逐渐减弱,非金属性减弱,其氢化物的稳定性逐渐减弱,还原性逐渐增强,故B错误;
C、ⅥA族中,O的非金属性最强,且水中含氢键,沸点最高为水无毒,故C正确;
D、碱金属中原子半径越大,熔点越低,而卤素单质中原子半径越大,熔点越高,则同一主族的元素,原子半径越大其单质的熔点不一定高,故D错误;
故选C.
点评 本题考查元素周期表和元素周期律,把握元素在周期表中的位置、性质即可解答,注意利用特例分析,题目难度不大,注重基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | 氧化物:CO2NO SO2H2O | |
| B. | 碱:NaOH KOH Ba(OH)2Na2CO3 | |
| C. | 铵盐:NH4Cl NH4NO3(NH4)2SO4NH3-H2O | |
| D. | 碱性氧化物:Na2O CaO Mn2O7 Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
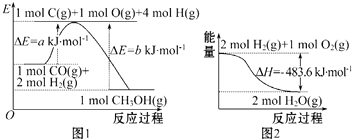
| A. | 根据图 1 可知合成甲醇的热化学方程式为CO(g)+2H2 (g)=CH 3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图 2 表示 2 mol H2(g)所具有的能量比 2 mol气态水所具有的能量多 483.6 kJ | |
| C. | 1 mol NaOH 分别和 1 mol CH3COOH、1 mol HNO3 反应,后者比前者△H 小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A2 的浓度,有利于该反应平衡逆向移动 | |
| B. | 升高温度有利于该反应平衡正向移动 | |
| C. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| D. | 增大压强有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
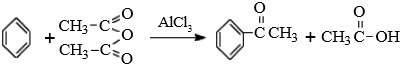
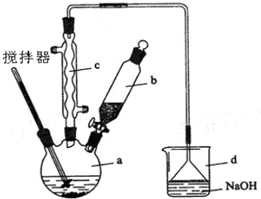
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳水化合物都符合通式Cn(H2O)m | |
| B. | 符合通式Cn(H2O)m的物质都是糖类 | |
| C. | 糖类物质都有甜味 | |
| D. | 糖类是人类维持生命的六大营养素之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com