
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
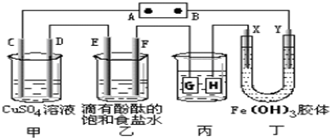
 (探究题)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
(探究题)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (Ⅰ)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(Ⅰ)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期期中考试实验班化学试卷(解析版) 题型:填空题
I.已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+140kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
II.将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
则可以判断该分解反应已经达到平衡状态的是 。
A.2v正(NH3)=v逆(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
III.以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。电池的一极通入O2和CO2,电极反应式为:O2+2CO2+4e-=2CO32-;另一极通入丙烷,电极反应式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
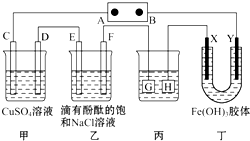
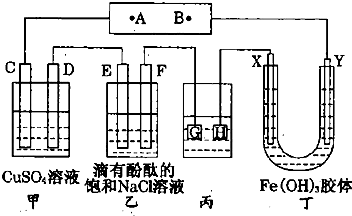
IV.如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
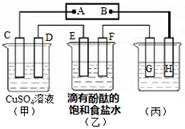
⑴若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
⑵现用丙装置作“铜的电解精炼”,则H应该是 。(填“纯铜”或“粗铜”)。
⑶上图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体 L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com