
 2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ��1mol N2��3mol H2��ƽ���NH3���������Ϊa�����ں��¡�������������ƽ����ϵ��ͨ��lmol N2��3mol H2��ƽ���NH3���������Ϊb����a b������ڡ��������ڡ�����С�ڡ�����
2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ��1mol N2��3mol H2��ƽ���NH3���������Ϊa�����ں��¡�������������ƽ����ϵ��ͨ��lmol N2��3mol H2��ƽ���NH3���������Ϊb����a b������ڡ��������ڡ�����С�ڡ�����
| A���������� | B����Һ��Ϊ��ɫ | C����Һ��ɫ��dz | D���к��ɫ�������� |


 һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)�ﻯѧƽ��״̬�ı�־��
2Z(g)�ﻯѧƽ��״̬�ı�־��| A��Z������������Z�ķֽ�������� |
| B����λʱ������amolX��ͬʱ����3a molY |
| C��X��Y��Z��Ũ����� |
| D��X��Y��Z�ķ�������Ϊ1:3:2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 x Z(g) ��H��0
x Z(g) ��H��0| ���������� | ���������� | ��ѹ������ | |
| ��Ӧ��Ͷ���� | 3 mol X 1 mol Y | 1.2 mol X 0.4 mol Y 1.2 mol Z | 3 mol X 1 mol Y |
| X��Ũ�ȣ�mol��L�D1�� | c1 | c2 | c3 |
| Z��������� | ��1 | ��2 | ��3 |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ƽ��״̬ | B���Ƿ��ȷ�Ӧ |
| C�������� | D�����Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2 NH3 ��ÿ����2 mol NH3�ų�92.4 kJ�����������ں��º�ѹ���ܱ������н�������ʵ�飺��ͨ��1 mol N2��3 mol H2����ƽ��ʱ�ų�����ΪQ1����ͨ��2 mol N2��6 mol H2����ƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����
2 NH3 ��ÿ����2 mol NH3�ų�92.4 kJ�����������ں��º�ѹ���ܱ������н�������ʵ�飺��ͨ��1 mol N2��3 mol H2����ƽ��ʱ�ų�����ΪQ1����ͨ��2 mol N2��6 mol H2����ƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����| A��Q2 =" 2" Q1 | B��Q1 < 0.5 Q2 | C��Q1 < Q2 < 184.8 kJ | D��Q1 = Q2 < 92.4 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)����H=��akJ��mo1��2����ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������( )
2SO3(g)����H=��akJ��mo1��2����ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������( )| A��4 mo1SO2��2mol O2 | B��4mol SO2��2mo1 O2��2mol SO3 |
| C��4mol SO2����4 mo1 O2 | D��6mo1 SO2��4 mo1 O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
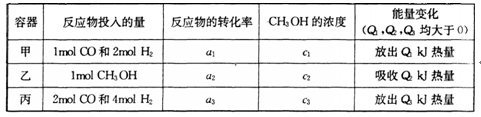
 �������ͼʾ�ش��������⣺
�������ͼʾ�ش��������⣺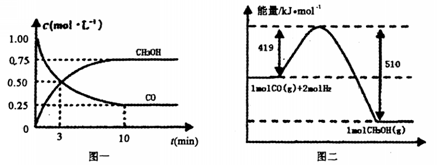
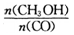 �������________________
�������________________
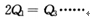
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��A������C���ʵķ�Ӧ����֮��Ϊ1��2 |
| B����λʱ��������a mol A��ͬʱ����3a mol C |
| C�������ڵ�ѹǿ���ٱ仯 |
| D�������������ʵ������ٱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
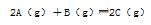 �������ڿ�ʼ�������и������ʣ��ﵽƽ��ʱ�淴Ӧ������С����
�������ڿ�ʼ�������и������ʣ��ﵽƽ��ʱ�淴Ӧ������С����| A��2molA��1molB | B��1molA��1molB |
| C��1molA��2molB | D��1molB��1molC |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com