
【题目】下列物质加入水中,会显著放热的是( )
A. 硝酸铵B. 乙醇C. 食盐D. 生石灰
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 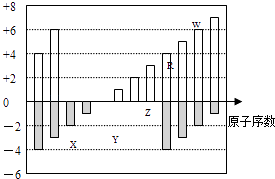
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由事实得出的结论错误的是( )
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性
D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中,甲烧杯中盛有100mL 0.50molL﹣1 AgNO3溶液,乙烧杯中盛有100mL 0.25molL﹣1CuCl2溶液,A,B,C,D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则 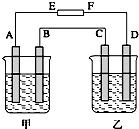
(1)电源E为极,F为极.
(2)A极的电极反应式为 , 析出物质mol.
(3)B极的电极反应式为 , 析出气体mL(标).
(4)C极的电极反应式为 , 析出的物质mol.
(5)D极的电极反应式为 , 析出气体mL(标况).
(6)甲烧杯中滴入石蕊试液,极附近变红,若继续电离,在甲烧杯中最终得到溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L0.1molNaAlO2和0.1mol Ba(NO3)2 的混合溶液中,逐滴加入浓度为0.1mol/L 的H2SO4 溶液,下列图象中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2﹣和Ba2+可以大量共存)( )
A.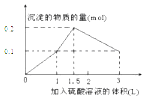
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
(1)写出基态E原子的电子排布式 .
(2)1mol A的单质分子中π键的个数为 .
(3)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(4)A的简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(5)C和D形成的化合物的晶胞结构如图,已知晶胞边长a cm,阿伏加德罗常数为NA , 求晶体的密度为ρ=g/cm3 . (用含a、NA的计算式表示) 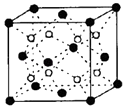
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( ) 
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3﹣6e﹣=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+ ![]() Fe3+
Fe3+ ![]() FeO
FeO ![]() (高铁酸根离子)回答下列有关问题:
(高铁酸根离子)回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是 .
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是 , 每生成l mol Na2FeO4转移mol电子.
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式: .
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯分子是平面结构,因此,1,2﹣二氯乙烯可以形成 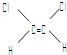 和
和 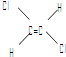 两种不同的空间异构体.下列各物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体.下列各物质中,能形成类似上述两种空间异构体的是( )
A.1﹣丁烯
B.丙烯
C.2﹣甲基﹣2﹣丁烯
D.2─丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com