
一定能在下列溶液中大量共存的离子组是()
①含有大量Al3+的溶液中:Na+、NH4+、SO42﹣、Cl﹣
②加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
③含有大量Fe3+的溶液中:Na+、Mg2+、NO3﹣、SCN﹣
④在含有大量AlO2﹣的溶液中:NH4+、Na+、Cl﹣、H+
⑤由水电离出的c(H+)=1×10﹣14mol•L﹣1的溶液中:Ca2+、K+、Cl﹣、HCO3﹣.
A. ①② B. ①③⑤ C. ① D. ①④⑤
考点: 离子共存问题.
专题: 离子反应专题.
分析: ①含有大量Al3+的溶液中,Na+、NH4+、SO42﹣、Cl﹣离子之间不发生反应,也不与铝离子反应;
②加入Al能放出H2的溶液为酸性或者强碱性溶液,碳酸氢根离子既能够与酸反应,也能够与碱溶液反应;
③含有大量Fe3+的溶液中,铁离子与硫氰根离子反应生成硫氰化铁;
④在含有大量AlO2﹣的溶液中,偏铝酸根离子与氢离子反应;
⑤由水电离出的c(H+)=1×10﹣14mol•L﹣1的溶液中存在大量氢离子或氢氧根离子,钙离子与氢氧根离子反应、碳酸氢根离子与氢离子和氢氧根离子都反应.
解答: 解:①含有大量Al3+的溶液中,Na+、NH4+、SO42﹣、Cl﹣离子之间不反应,且都不与Al3+反应,在溶液中能够大量共存,故①正确;
②加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,HCO3﹣与氢离子、氢氧根离子反应,NH4+与氢氧根离子反应,在溶液中一定不能大量共存,故②错误;
③Fe3+与SCN﹣反应生成络合物硫氰化铁,在溶液中不能大量共存,故③错误;
④AlO2﹣与H+发生反应,在溶液中不能大量共存,故④错误;
⑤由水电离出的c(H+)=1×10﹣14mol•L﹣1的溶液为酸性或者碱性溶液,Ca2+、HCO3﹣都一氢氧根离子反应,HCO3﹣与氢离子反应,在溶液中一定不能大量共存,故⑤错误;
故选C.
点评: 本题考查离子共存的正误判断,而2015届高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN﹣)等;还要明确题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 元素处于最高价态时一定有强氧化性;同理元素处于最低价态时一定具有强还原性
B. 将FeCl2溶液与稀HNO3混合离子反应方程式:Fe2++4H++NO3﹣═Fe3++NO↑+2H2O
C. HF、Al(OH)3、氨水都是弱电解质
D. 颜色反应、显色反应、指示剂变色反应均属化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是()
A. x:y等于甲与乙的相对分子质量之比
B. x:y等于等质量的甲与乙的分子个数之比
C. x:y等于同温同压下甲与乙的密度之比
D. y:x等于同温同体积下等质量的甲与乙的压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图与对应选项不正确的是()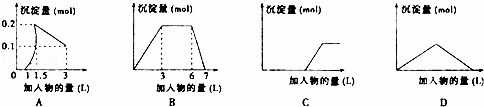
A. 向1L浓度均为0.1mol•L﹣1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol•L﹣1稀H2SO4溶液
B. 向含有0.1 mol•L﹣1 AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1 mol•L﹣1NaOH溶液
C. 向烧碱溶液中逐滴加入明矾溶液
D. 向Ba(OH)2溶液中逐渐通入二氧化碳气体
查看答案和解析>>
科目:高中化学 来源: 题型:
配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏小的是( )
A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容
B. 在容量瓶中进行定容时仰视刻度线
C. 在容量瓶中定容时俯视刻度线
D. 定容后把容量瓶倒转摇匀,发现液面低于刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果.例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢和高碳钢,利用数轴的分类法可将其表示为
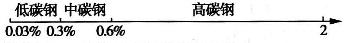
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
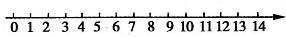
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质: .
③在方案Ⅱ中,三种钠盐用其他化合物中的H2SO4可加以区分,有关反应的化学方程式分别为 .
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质): ;.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com