


科目:高中化学 来源: 题型:
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
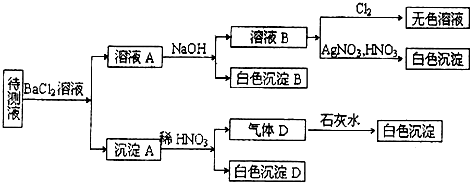
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
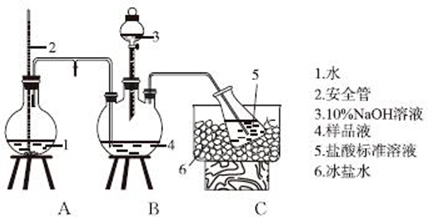
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com