
����Ŀ�������ʹ�����ϵ���ɳ��﮶�����̼��ر���Ϊ���ɺ������2.0��,�õ�ص��ܷ�ӦʽΪ:Li+CO2+O2![]() Li2CO3(δ��ƽ).�乤��ԭ������ͼ��ʾ(�ŵ�ʱ������̼��﮹��崢����̼������,TEGDME��һ���л��ܼ�)������˵������ȷ����
Li2CO3(δ��ƽ).�乤��ԭ������ͼ��ʾ(�ŵ�ʱ������̼��﮹��崢����̼������,TEGDME��һ���л��ܼ�)������˵������ȷ����
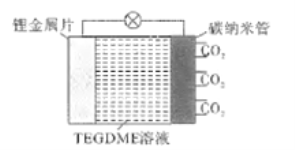
A. �ŵ�ʱ,CO2������ԭ��Ӧ
B. ����1.12L.CO2���뷴Ӧ,����0.2mol���ӷ���ת��
C. �ŵ�ʱ��Li+���������ƶ�
D. ���ʱ,������ӦΪ2Li2CO3-4e-=2CO2��+O2��+4Li+

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��CO��CO2��NOx�ǶԻ���Ӱ��ϴ�ļ������壬�����ǵĺ������ƺ��������Ż��������滷������Ч;����

��1�����õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�ϣ�װ����ͼ1��ʾ��
����AΪCO��BΪH2��CΪCH3OH����ͨ��CO��Ϊ_________��(����������������)��
����AΪSO2��BΪO2��CΪH2SO4�����ĵ缫��ӦʽΪ��___________________________��
��2��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650�����ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1��1��ֱ����ȼ�ϣ��乤��ԭ����ͼ2��ʾ��
������ܷ�ӦΪ____________________________________________��
���Դ˵�Դ�����������������Һ�����������������Ϊ21.6g��������Һ���Ϊ2L����Һ��pHԼΪ___________��
��3��ij�о�С����������װ����N2O4��������������N2O5��

������H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O5��װ����ͼ��ʾ������YΪCO2���ڸõ缫��ͬʱ������CO2��Ŀ����__________________________��
���������У�����N2O5�ĵ缫��Ӧ����ʽΪ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ����������������X��ԭ�Ӱ뾶С��Y��ԭ�Ӱ뾶��Z�ĵ����ǿ����к�����ߵ�������Wԭ��������Yԭ���������1�����ӣ�W�ĵ����ƵõĽ������������¿�ʢװŨ���ᡣ����˵����ȷ����
A. Y��X���Էֱ��γ�ԭ�Ӹ�����Ϊ1��1��1��2��1��3��1��4�Ļ�����
B. ����������Ӧ��ˮ����������Y>Z>W
C. ԭ�Ӱ뾶��X<Y<Z<W
D. �����Ӱ뾶��W>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CoCO3������ѡ�����������αװͿ�ϵ����ϡ��Ժ��ܷ���(��Ҫ��CoO��Co2O3��������Al2O3��ZnO������)Ϊԭ���Ʊ�CoCO3��һ�ֹ�������������
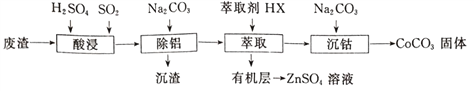
�±�����ؽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0mol��L-1����)��
�������� | ��ʼ������pH | ������ȫ��pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
��1��д����������ʱ����������ԭ��Ӧ�Ļ�ѧ����ʽ_________________��
��2������������������Ҫ������ҺpH�ķ�ΧΪ______________���γɳ���ʱ������Ӧ�����ӷ���ʽΪ_____________________��
��3����ʵ����������ȡ�����õ��IJ���������Ҫ��____________����������ȡ�����̿ɱ�ʾΪZnSO4(ˮ��)+2HX(�л���) ![]() ZnX2(�л���)+H2SO4(ˮ��)�����л����ȡZnSO4��Һ�IJ�����_________________________��
ZnX2(�л���)+H2SO4(ˮ��)�����л����ȡZnSO4��Һ�IJ�����_________________________��
��4����������ʱ��Na2CO3��Һ�μӹ���ᵼ�²�Ʒ�����������ԭ��_________________��
��5���ڿ���������CoCO3�������������CO2����ó�����պ��������Ϊ2.41g��CO2�����Ϊ0.672L(��״��)�������������Ļ�ѧʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֳ���������F��һ�ֺ��ɫ�������Ը���ͼ��ת����ϵ���ش��������⡣
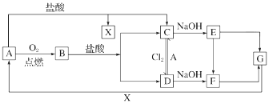
��1��д��A��C��F��G�Ļ�ѧʽ��A________��C________��F________��G________��
��2������C��ҺʱҪ�ӹ���A��ԭ����______________________��
��3��д������ת�������ӷ���ʽ��
��D��C��___________________________________________________��
��C��D��___________________________________________________��
��B��C��D__________________________________________________��
��4��д��E��F�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,��0.01mol/L��NaOH��Һ�ζ�ijŨ�ȵ�H2N2O2(��Ԫ����)��Һ,������Һ��H2N2O2��HN2O2-��N2O22-�����������ʵ�������(��)����ҺPH�Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����
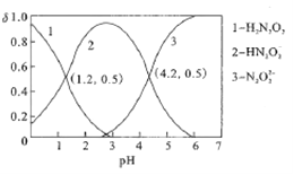
A. �õζ�����Ӧ��ѡ�������Ϊָʾ��
B. Ka1(H2N2O2)��������Ϊ10-4.2
C. pH=1.2��Һ��:c(Na+)+c(H+)=c(OH-)+c(H2N2O2)
D. pH=4.2��Һ��:c(Na+)>2c(N2O22-)+c(HN2O2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ����ֱ�����Na��O��H�γɵĵ��ʣ�A��B��C����H��0��Na����Ԫ���е����ֻ�������ɵĻ�������ֵ����뻯����֮�ʴ�����ͼ��ʾ��ת��Цϵ��

��ش�
��1��д���������ʵĻ�ѧʽA________��B_________��C_______��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��
�����ʼ�+������B_____________________________��
��������A+������B___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ܸ�H+����������ǣ�������
A.OH��
B.CO32��
C.SO32��
D.SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£����ڿ��淴ӦX (g) +4Y (g) ![]() 2Z (g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3 (����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷքeΪ0.lmol/L��0.4mol/L�� 0.1mol/L���������ж���ȷ����( )
2Z (g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3 (����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷքeΪ0.lmol/L��0.4mol/L�� 0.1mol/L���������ж���ȷ����( )
A. c1��c2=4��1 B. ƽ��ʱ��Y��Z����������֮��Ϊ1: 2
C. c1��ȡֵ��ΧΪ0mol/L<c1<0.14mol/L D. X��Y��ת�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com