
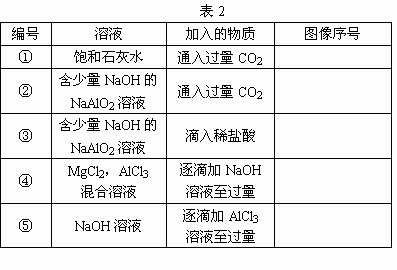
如图中,横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量:
从A~D中选择符合要求的选项填入表2的相应位置.

|
【答案】①B;②C;③D;④A;⑤C 【解析】①饱和石灰水中通入二氧化碳,立即生成沉淀,当通入过量二氧化碳时,沉淀逐渐溶解,当通入二氧化碳跟原溶液中氢氧化钙的物质的量比为2∶1时,沉淀完全溶解,反应的化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O, CaCO3+H2O+CO2=Ca(HCO3)2;故选B. ②二氧化碳通入含氢氧化钠的偏铝酸钠溶液中,首先跟氢氧化钠反应,没有沉淀生成:2NaOH+CO2=Na2CO3+H2O,把氢氧化钠都中和完以后,接着二氧化碳跟偏铝酸钠反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,当偏铝酸钠反应完以后,再通入二氧化碳,沉淀不再增加,但是也不会溶解,故选C. ③稀盐酸加到含氢氧化钠的偏铝酸钠溶液中时,首先中和氢氧化钠,没有沉淀生成:NaOH+HCl=NaCl+H2O,然后盐酸跟偏铝酸钠反应,生成的氢氧化铝沉淀又溶解于盐酸中: NaAlO2+HCl+H2O=Al(OH)3↓+NaCl, Al(OH)3+3HCl=AlCl3+3H2O;故选D. ④氢氧化钠逐滴加到氯化镁和氯化铝的混合溶液中,观察到有白色沉淀生成,沉淀逐渐增加: MgCl2+2NaOH=Mg(OH)2↓+2NaCl, AlCl3+3NaOH=Al(OH)3↓+3NaCl; 当溶液中的Mg2+,Al3+都反应完时,沉淀量最大,再加过量的氢氧化钠溶液,沉淀开始减少,到氢氧化铝全部溶解时,沉淀的量不再减少.Al(OH)3+NaOH=NaAlO2+2H2O,故选A. ⑤三氯化铝逐滴加到氢氧化钠溶液时,观察到有白色沉淀,由于氢氧化钠过量,振荡,沉淀溶解,直至氢氧化钠消耗尽: AlCl3+3NaOH=Al(OH)3↓+3NaCl, Al(OH)3+NaOH=NaAlO2+2H2O; 继续滴加三氯化铝,有白色沉淀生成,沉淀量不断增加,当溶液中 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl,故选C. 【拓展延伸】本题属于较难的学科综合题,结合了物质性质、实验操作、图像分析等诸多难点.对于这一类题目,不能畏惧,要沉住气,细致审题,紧抓图像中的关键转折点,结合物质的性质,将相应的实验结果与图像对应起来. |


科目:高中化学 来源: 题型:
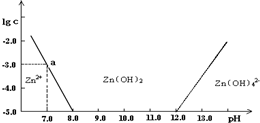 常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )
常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、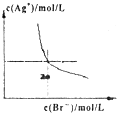 如图是某温度下将AgBr溶于水,c(Ag+)、c(Br-)的关系曲线,a点表示不饱和溶液 | B、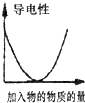 如图可能是在醋酸溶液中不断加入氨水,溶液的导电性情况 | C、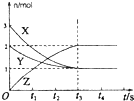 由图知,该反应的化学方程式为:3X+2Y=2Z | D、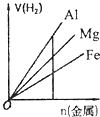 如图是可能镁、铝、铁与足量盐酸的反应,纵坐标表示的是生成氢气体积,横坐标表示的是三种金属的物质的量 |
查看答案和解析>>
科目:高中化学 来源:2012届新疆兵团二中高三第一次月考化学试卷 题型:填空题
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | | | | | | | |
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103c(PbCl2) | | | | | | | |
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com