
| A. | 食用加碘食盐以防止碘缺乏病 | |
| B. | 使用铁锅炒菜可以减少贫血病的发生 | |
| C. | 保持科学的饮食习惯,全面摄入各种微量元素 | |
| D. | 多吃各种营养品,以增大微量元素的吸收 |
科目:高中化学 来源: 题型:选择题
| A. | 5.6g | B. | 2.8g | C. | 11.2g | D. | 1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 液氨作为清洁能源的反应原理是:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
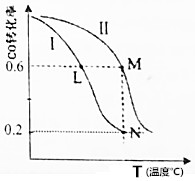
| A. | 该反应的△H>0 | |
| B. | M点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1molCH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

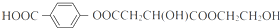 .
. .
.
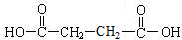 .
.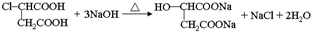 .
.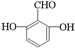 、
、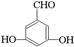 、
、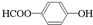 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com