
����Ŀ��ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�䴿�ȣ��������µζ�������
A����250mL����ƿ�ж��ݳ�250mL�ռ���Һ
B������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��μ���ָʾ��
C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ�
D�������ʵ���Ũ��ΪM mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�ΪV1mL
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL
�ش��������⣺
��1����ȷ�IJ��������˳���ǣ�����ĸ��д�� ��
��2���ζ��ܶ���Ӧע�� ��
��3������E�е���ƿ�µ�һ�Ű�ֽ��������
��4������D��Һ��Ӧ������ �� ���첿��Ӧ ��
��5���ζ��յ�ʱ��ƿ����Һ��pH ԼΪ �� �յ�ʱ��ɫ�仯�� ��
��6������ʽ�ζ���û���ñ�H2SO4��ϴ����Բⶨ����к�Ӱ�����ƫ�ߡ���ƫ�͡�����Ӱ�족��������������ȷ��
��7�����ռ���Ʒ�Ĵ��ȼ���ʽ�� ��
���𰸡�
��1��C��A��B��D��E
��2���ζ��ܴ�ֱ��Һ�治�ٱ仯ʱ�ſɶ�������������Һ��Һ����͵���ƽ��������ȷ��0.01ml
��3������ȷ�ж��յ�ʱ��ɫ�ı仯���
��4�����ڵ���̶Ȼ������µ�ijһ�̶ȣ�������H2SO4��Һ
��5��4����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ�Ϊԭ������ɫ
��6��ƫ��
��7��![]() ��100%
��100%
���������⣺��1��ʵ��ʱӦ�ȳ���һ�������Ĺ��壬�ܽ�����Ƴ���Һ����ȡ����Һ����ƿ�У�Ȼ���ñ�Һ���еζ������岽��Ϊ��C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ�A����250mL����ƿ�ж��ݳ�250mL�ռ���ҺB������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��μ���ָʾ��D�������ʵ���Ũ��ΪM mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�ΪV1mLE������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL���Դ��ǣ�C��A��B��D��E����2���ζ��ܴ�ֱ��Һ�治�ٱ仯ʱ�ſɶ�������������Һ��Һ����͵���ƽ���ζ��ܶ���ȷ��0.01ml�����Դ��ǣ��ζ��ܴ�ֱ��Һ�治�ٱ仯ʱ�ſɶ�������������Һ��Һ����͵���ƽ��������ȷ��0.01ml����3������ƿ�µ�һ�Ű�ֽʹ�ζ��յ���ɫ�仯�����ԣ����ڷֱ棬���Դ��ǣ�����ȷ�ж��յ�ʱ��ɫ�ı仯�������4���ζ���0�̶����ϣ��ζ�ǰӦ���ڵ���̶Ȼ������µ�ijһ�̶ȣ�Ϊ��С�����첿��Ӧ����Һ�壬�����ݣ����Դ��ǣ����ڵ���̶Ȼ������µ�ijһ�̶ȣ�������H2SO4��Һ����5��ָʾ��Ϊ���ȣ���ɫ��ΧΪ3.1��4.4���յ�ʱpHԼΪ4����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ�Ϊԭ������ɫ�����Դ��ǣ�4����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ�Ϊԭ������ɫ����6�����ҺŨ�ȱ�С������������Դ��ǣ�ƫ�ߣ���7���ε����ĵ�����Ϊ��n�����ᣩ=cV=��V2��V1����10��3L��Mmol/L�����ݷ�Ӧ���̿�֪��n��NaOH��=2n�����ᣩ=2M��V2��V1����10��3mol������ԭ����Ʒ���������Ƶ����ʵ���Ϊ��2M��V2��V1����10��3mol�� ![]() =2M��V2��V1����10��2mol������Ʒ���������Ƶ�����Ϊm��NaOH��=nM=80M��V2��V1����10��2g������ռ���Ʒ�Ĵ���Ϊ��
=2M��V2��V1����10��2mol������Ʒ���������Ƶ�����Ϊm��NaOH��=nM=80M��V2��V1����10��2g������ռ���Ʒ�Ĵ���Ϊ�� ![]() ��10��2��100%=
��10��2��100%= ![]() ��100%�����Դ��ǣ�
��100%�����Դ��ǣ� ![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ͬ��ͬѹ�£���ͬ��������ʣ������ʵ���һ�����
B. �κ������£������ʵ�����CH4��CO�����ķ�����һ�����
C. 1LCO����һ����1LO2������С
D. �������CO�����N2�����ǵ�����Ҳһ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�ó������ⶨNa2SO3��NaCl����������Na2SO3�����������������������£� 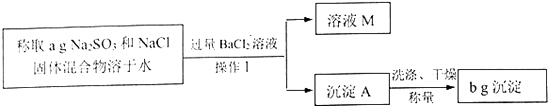
��1������I���õ��IJ����������ձ����������� ��
��2������I֮ǰ��Ϊ�ж�����BaCl2��Һ�Ƿ������������·������������������ ��
A.ȡ�����ϲ���Һ�������μ�ϡH2SO4 �� ������������˵��BaCl2�ѹ���
B.����Һ��������μ�BaCl2��Һ��������������˵��BaCl2�ѹ���
C.����Һ��������μ�ϡH2SO4 �� ������������˵��BaCl2�ѹ���
��3�����ݲ��������е����ݼ���Na2SO3���������� ��
��4����ͬѧ�������������ʵ���������ȷ��������ʵ������Ԥ�����ϴ������Ʋ���ܵ�ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ɶ��������Ʊ�������ؿɷֶ������У���һ���������������������ع��۲�ͨ������2MnO2+4KOH+O2�T2K2MnO4+2H2O���ڶ���������������Һ��2K2MnO4+2H2O ![]() 2KMnO4+H2��+2KOH������˵����ȷ���ǣ� ��
2KMnO4+H2��+2KOH������˵����ȷ���ǣ� ��
A.�����������̣�ÿ����1molKMnO4 �� ��ת��6mol����
B.�ڶ������ʱ�������缫��ӦʽΪ2MnO42����2e��=2MnO4��
C.�ڶ����������ӷ���ʽΪ��2H2O ![]() H2��+OH��
H2��+OH��
D.�ڶ������ʱ������ΧpH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������ȼ�ϵ����Ca��HSO4��2����Ϊ����ʴ���H+ �� ������ṹ��ͼ������ܷ�Ӧ�ɱ�ʾΪ��2H2+O2=2H2O�������й�˵����ȷ���ǣ� �� 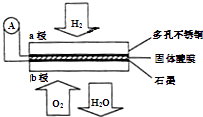
A.����ͨ�����·��b������a��
B.ÿת��0.1mol���ӣ�����1.12L��H2
C.H+��a��ͨ�����������ʴ��ݵ�b��
D.b���ϵĵ缫��ӦʽΪ��O2+2H2O+4e���T4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe��OH��2���ױ�����������ʵ����������������Һ���ռӦ�Ƶð�ɫ������Fe��OH��2������������ͼ��ʾʵ��װ�ÿ��Ƶô�����Fe��OH��2�������������Ϸֱ�Ϊʯī������ 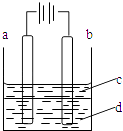
��1��a�缫����Ϊ �� ��缫��ӦʽΪ ��
��2�����Һd������ �� ���ɫ�����ڵ缫�����ɣ�Ҳ������ �� ���ɫ����������֮�����Һ�����ɣ�������ţ�
A����ˮ B��NaCl��Һ C��NaOH��Һ D��CuCl2��Һ
��3��Һ��cΪ������������ �� �ڼ��뱽֮ǰ����d��Һ���м�����д�����Ŀ���� ��
��4��Ϊ���ڶ�ʱ���ڿ�����ɫ�������ɲ�ȡ�Ĵ�ʩ�� �� ������ţ�
A.����ϡ���������Һ
B.�ʵ������Դ��ѹ
C.�ʵ���С���������
D.�ʵ����͵��Һ�¶�
��5����d��ΪNa2SO4��Һ�������һ��ʱ�䣬������ɫ�������ٷ��ӵ�Դ��������⣬���˵缫�Ͽ��������⣬��һ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�������ѧ��ȤС�鰲װ������ͼ1��ͬװ�ã�����̽��Ӱ��H2O2�ֽ����ʵ����أ� 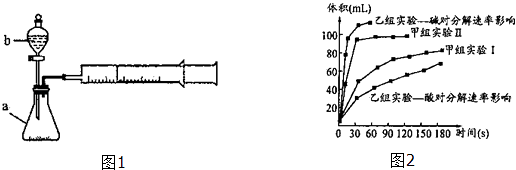
��1������b�����ƣ� ��
��2����С��������ʵ����Ʒ�������������������գ�
ʵ���� | ʵ��Ŀ�� | t�� | ���� | Ũ�� |
����ʵ��� | ��ʵ����� | 25 | 10mL 2%H2O2 | |
����ʵ��� | ̽��Ũ�ȶ����ʵ�Ӱ�� | 25 | 10mL 5%H2O2 |
��3���ס�����С��ó���ͼ2���ݣ� ���ɼ���ʵ��ó������ݿ�֪��Ũ��Խ��H2O2�ֽ��������Խ�족����Խ��������
���������о����ᡢ���H2O2�ֽ�Ӱ�����ص����ݷ�����ͬ�����£�Na2O2��K2O2����ˮ�ų��������ʽϿ������
���������������BaO2������H2SO4��Һ��Ӧ��H2O2 �� �仯ѧ��Ӧ����ʽΪ��֧����һ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����͵��Ҵ���أ����û����������ܼ�������ܷ�ӦΪ��C2H5OH+3O2��2CO2+3H2O�����ʾ����ͼ������˵����ȷ���ǣ� ��
A.a��Ϊ��ص�����
B.��ع���ʱ������a���ص��߾������ٵ�b��
C.��ظ����ĵ缫��ӦΪ��4H++O2+4e��=2H2O
D.��ع���ʱ��1mol�Ҵ�������ʱ����12mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؽ������ʵ�������ȷ���ǣ� ��
A.�����кܸߵ��۵�
B.�������������� 3 ���Ķ��ǽ���
C.���ܵ��硢����
D.��ֻ�ܺ���ܺͼ����ѧ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com