
离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质 ( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.②⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年黑龙江大庆中学高一上期中化学试卷(解析版) 题型:选择题
在标准状况下有:①6.72 L CH4,②3.01×1023个HCl分子,③13.6 g H2S,④0.2 mol NH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个 数①>③>④>②
数①>③>④>②
A.abc B.bcd C.cbd D.abcd
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高二上10月月考化学卷(解析版) 题型:实验题
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
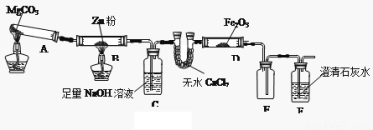
(1)MgCO3的分解产物为 。装置B中的反应方程式为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
已知:Fe2+与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2(蓝色沉淀)
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③从实验安全考虑,上图装置还可采取的改进措施是 ;
④乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ,其验证方法为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上期中化学试卷(解析版) 题型:实验题
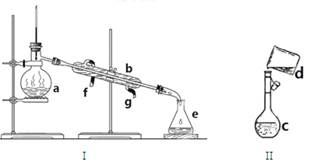
(1)写出下列仪器的名称:
a. b. c. e.
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 。冷凝水由 (填f或g)口通入。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。
②根据计算得知,用托盘天平所需称量NaOH的质量为 g。
③配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶 |
B.称量计算出的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解并冷却至室温 |
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)物质的量浓度误差分析:(填偏高、偏低、无影响)
①用滤纸称量氢氧化钠 ;
②定容时,若眼睛俯视刻度线,则所配制的溶液浓度将 ;
③未冷却到室温就注入容量瓶定容 ;
④配好的溶液转入干净的试剂瓶时,不慎溅出部分溶液 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上期中化学试卷(解析版) 题型:选择题
下列有关氧化还原反应的叙述正确的是( )
A. 氧化还原反应的本质是元素化合价发生变化
B. 物质所含元素化合价降低的反应是氧化反应
C. 置换反应一定属于氧化还原反应
D. 化合反应和分解反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上期中化学试卷(解析版) 题型:选择题
同 温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同。若相同条件下, A气球放在CO中静止不动,B气球放在O2中上浮。下列叙述或表示正确的是( )
温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同。若相同条件下, A气球放在CO中静止不动,B气球放在O2中上浮。下列叙述或表示正确的是( )
A.X气体的相对分子质量比Y气体的相对分子质量大
B.X可能是N2,Y可能是CH4
C.X气体的密度小于Y气体的密度
D.充气后A气球质量比B气球质量大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学试卷(解析版) 题型:填空题
合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) Δ
2NH3(g) Δ H=QkJ·mol-1,能量变化如图所示,回答下列问题:
H=QkJ·mol-1,能量变化如图所示,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”,下同);E2—E1 _________
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_________ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________
A.ΔH>0,气体分子数目增 多 B.ΔH>0,气体分子数目减少
多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol ,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的________填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学试卷(解析版) 题型:选择题
设C+CO2 2CO(正反应吸热),反应速率为v1;N2+3H2
2CO(正反应吸热),反应速率为v1;N2+3H2 2
2 NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况是( )
NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况是( )
A.同时增大 B.同时减小 C.v1增加,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨三中高二上期中文化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na++2OH一+H2↑
B.碳酸氢钠与盐酸反应:CO32—+2H+=H2O+CO2↑
C.铁与稀硫酸反应:Fe+2H+=Fe3++H2↑
D.醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH一=CH3COO一+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com