
分析 (1)某水溶液M中存在的分子有H2O、H2A,则H2A为弱酸;
(2)等体积混合生成Na2A,水解显碱性,离子水解以第一步为主;
(3)难溶电解质MmAn在水溶液中存在溶解平衡,MmAn(s)?mMn+(aq)+nAm-(aq),难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示.即:[Mn+]m•[Am-]n=Ksp,判断在20克水中加入1克硫酸银固体,溶液饱和,据硫酸银的Ksp计算银离子浓度;
(4)氨水和盐酸的混合溶液中只有4种离子,据电荷守恒可知溶液显中性,则c(OH-)=1.0×10-7,c(NH4+)═c(Cl-)=0.005mol/L,c(NH3•H2O)=(a-0.005)mol/L,据此分析.
解答 解:(1)溶液中存在的分子有H2O、H2A,则H2A为弱酸,其电离方程式为:H2A?H++HA-、HA-?H++A2-,
故答案为:H2A?H++HA-、HA-?H++A2-;
(2)10mL 2mol•L-1NaHA溶液与10mL 2mol•L-1NaOH溶液混合生成Na2A,水解显碱性,pH>7,离子水解以第一步为主,则离子浓度关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),
故答案为:>;c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
(3)难溶电解质MmAn在水溶液中存在溶解平衡,MmAn(s)?mMn+(aq)+nAm-(aq),难溶电解质MmAn在水溶液中存在溶解平衡:其溶度积常数表达式为Ksp=cm(Mn+)•cn(Am-);已知某温度下难溶电解质硫酸银在水溶液中Ksp=1.08×10-16,即每100克水仅溶解0.836克硫酸银,在20mL水中加入1克硫酸银固体,为饱和溶液,有[Ag+]2×[SO42-]=1.08×10-16,设[SO42-]为x,则有4x3=1.08×10-16,x=3×10-5,
故答案为:MmAn(s)?mMn+(aq)+nAm-(aq);Ksp=cm(Mn+)•cn(Am-);3×10-5;
(4)氨水的电离常数K=$\frac{[N{{H}_{4}}^{+}]•[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$=$\frac{0.005×1.0×1{0}^{-7}}{a-0.005}$mol/L,故答案为:$\frac{0.005×1.0×1{0}^{-7}}{a-0.005}$mol/L.
点评 本题考查了弱电解质的电离方程式书写、离子浓度大小比较、沉淀的溶解平衡以及关于溶度积的计算、弱电解质电离平衡常数的计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
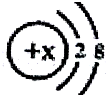 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com