
【题目】二氧化碳加氢合成乙烯的反应如下:2CO2(g )+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(1)ΔH2=bkJ/mol;
③H2O(1)=H2O(g) ΔH3=c kJ/mol;
请回答:
(1)ΔH=____kJ/mol。(用a、b、c 表示)
(2)在催化剂[Fe3(CO)12/ZSM-5]、空速1200 h-1 条件下,温度、压强、氢碳比[n(H2)/n(CO2)=x]对CO2平衡转化率及温度对催化效率影响如图1所示。
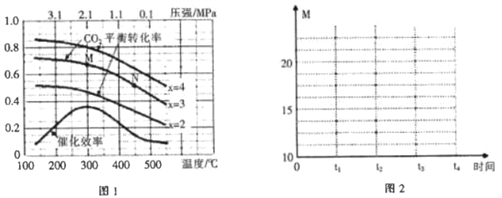
①下列有关说法正确的是________(填字母)。
A.ΔH>0
B.增大氢碳比,可以提高CO2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的产率增大
D.平衡常数:K(M)>K(N)
E.为提高CO2的平衡转化率,工业生产中应在尽可能低的温度下合成乙烯
②M点时,CO2的平衡转化率为2/3,则此时平衡体系中乙烯的体积分数为_________。
③工业生产中压强一般控制在2.1~2.6 MPa之间,理由是____________________________。
(3)恒温(300℃),在体积为1L的恒容容器中以n(H2)/n(CO2)=3的投料比加入反应物,至t1时达到平衡。t2时将容器体积瞬间扩大至2 L并保持不变,t3时重新达平衡。在图2中绘制0~t4时间段内,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像。_______
【答案】 3b+4c-a B D 1/9或11.1% 压强小于2.1MPa,CO2的平衡转化率较小;压强大于2.6MPa,CO2的平衡转化率提高幅度较小,运行成本增加  [起点12.5,t2低于20(实际为16.7),t3高于12.5]
[起点12.5,t2低于20(实际为16.7),t3高于12.5]
【解析】(1) 已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=akJ/mol;②2H2(g)+O2(g)=2H2O(1) ΔH2=bkJ/mol;③H2O(1)=H2O(g) ΔH3=ckJ/mol;根据盖斯定律,将②×3+③×4-①得:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=(3b+4c-a )kJ/mol,故答案为:3b+4c-a;
C2H4(g)+4H2O(g) ΔH=(3b+4c-a )kJ/mol,故答案为:3b+4c-a;
(2)①A.根据图像,CO2平衡转化率随温度升高而降低,说明升高温度,平衡逆向移动,正反应为放热反应,ΔH<0,故A错误;B.根据方程式2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),增大氢碳比(
C2H4(g)+4H2O(g),增大氢碳比(![]() ),可以提高CO2的平衡转化率,故B正确;C.根据A的分析,ΔH<0,温度升高,平衡逆向移动,乙烯的产率降低,故C错误;D.升高温度,平衡逆向移动,平衡常数减小,则平衡常数:K(M)>K(N),故D正确;E.根据图像,为提高CO2的平衡转化率,工业生产中应在300℃温度下合成乙烯,温度太低,催化剂的活性较低,反应速率太慢,故E错误;故选BD;
),可以提高CO2的平衡转化率,故B正确;C.根据A的分析,ΔH<0,温度升高,平衡逆向移动,乙烯的产率降低,故C错误;D.升高温度,平衡逆向移动,平衡常数减小,则平衡常数:K(M)>K(N),故D正确;E.根据图像,为提高CO2的平衡转化率,工业生产中应在300℃温度下合成乙烯,温度太低,催化剂的活性较低,反应速率太慢,故E错误;故选BD;
②设参与反应的二氧化碳的物质的量为3n,则氢气为9n,根据反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)可知,CO2的平衡转化率为2/3,平衡时n(CO2)=n mol,n(H2)=3nmol,n(C2H4)=nmol,n (H2O)=4nmol,平衡体系中乙烯的体积分数=物质的量分数=
C2H4(g)+4H2O(g)可知,CO2的平衡转化率为2/3,平衡时n(CO2)=n mol,n(H2)=3nmol,n(C2H4)=nmol,n (H2O)=4nmol,平衡体系中乙烯的体积分数=物质的量分数=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
③根据图像,工业生产中压强一般控制在2.1~2.6MPa之间,是因为压强小于2.1MPa,CO2的平衡转化率较小;压强大于2.6MPa,CO2的平衡转化率提高幅度较小,运行成本增加,故答案为:压强小于2.1MPa,CO2的平衡转化率较小;压强大于2.6MPa,CO2的平衡转化率提高幅度较小,运行成本增加;
(3) 设参与反应的二氧化碳的物质的量为3mol,则氢气为9mol,起始时混合气体的平均相对分子质量(M)= ![]() =12.5;300℃时,CO2的平衡转化率为2/3,根据反应2CO2(g)+6H2(g)
=12.5;300℃时,CO2的平衡转化率为2/3,根据反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)可知,平衡时n(CO2)=1mol,n(H2)=3mol,n(C2H4)=1mol,n (H2O)=4mol,混合气体的平均相对分子质量(M)=
C2H4(g)+4H2O(g)可知,平衡时n(CO2)=1mol,n(H2)=3mol,n(C2H4)=1mol,n (H2O)=4mol,混合气体的平均相对分子质量(M)= ![]() =16.67;t2时将容器体积瞬间扩大至2L并保持不变,平衡逆向移动,气体的物质的量增大,但小于12mol,新平衡时混合气体的平均相对分子质量(M)减小,但大于12.5,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像为
=16.67;t2时将容器体积瞬间扩大至2L并保持不变,平衡逆向移动,气体的物质的量增大,但小于12mol,新平衡时混合气体的平均相对分子质量(M)减小,但大于12.5,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像为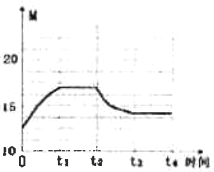 [起点12.5,t2低于20(实际为16.7),t3高于12.5],故答案为:
[起点12.5,t2低于20(实际为16.7),t3高于12.5],故答案为: [起点12.5,t2低于20(实际为16.7),t3高于12.5]。
[起点12.5,t2低于20(实际为16.7),t3高于12.5]。


科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
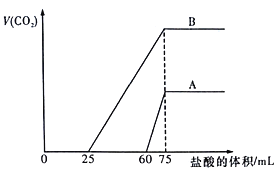
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为两种金属组成的合金,发生如下图所示的变化:

试填写以下空白:
(1)合金A由________和________组成。
(2)写出下列变化的离子方程式。
C→E______________________________________________________________;
D→F______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2。(乙烯的制取装置略)
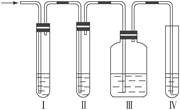
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛入的试剂是:Ⅰ______、Ⅱ______、Ⅲ______、Ⅳ______。(将下列有关试剂的序号填入空格内)
A. 品红溶液 B. NaOH溶液 C. 浓H2SO4 D. 酸性KMnO4溶液
②能说明SO2气体存在的现象是____________________。
③使用装置Ⅲ的目的是____________________________。
④确定含有乙烯的现象是_________________________。
(2)取一支试管,向其中加入10mL溴水,再加入5mL正己烷(分子式为C6H14,结构简式为CH3CH2CH2CH2CH2CH3)。将此试管中的混合液在光照下振荡后静置,液体分为几乎都是无色的上、下两层。用玻璃棒蘸取浓氨水伸入试管内液面上方,有白烟出现。
① 请写出生成白烟的化学反应方程式:_____________________________。
② 该实验证明了这是一个__________。
A.取代反应 B.加成反应 C.氧化反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L CCl4中含有的分子总数为0.1NA
B. 78 g Na2O2中含有的阴离子数为NA
C. 金属钠与水反应,生成22.4L氢气时,转移的电子数为2NA
D. 将含有1mol溶质的FeCl3溶液加入沸水中制取Fe(OH)3胶体,其含Fe(OH)3胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子化合物M(仅含三种元素)是一种镁基储氢材料。为探究M的组成和性质,设计并完成如下实验:
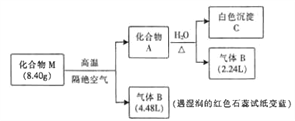
已知:气体的体积均在标准状况下测定,化合物A仅含两种元素。
请回答:
(1)化合物M中阳离子和阴离子的个数比为1:2,则M的化学式为_______________。
(2)化合物A 与H2O反应的化学方程式_______________。
(3)镁条在足量的气体B中燃烧可生成化合物M 和气体D,则D的分子式为_______________。
(4)研究表明液态B也是一种良好的储氢物质,其储氢容量可达17.6%,已知液态B中存在类似水的电离(2H2O![]() H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
①液态B的电离方程式________________。
②电解时,阴极的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO和CO2的混合气体,通过过量的Na2O2后,剩余气体体积为原来的一半,则NO和CO2的体积比为(不考虑NOx与Na2O2的反应及2NO2![]() N2O4)( )
N2O4)( )
A. 2:1 B. 1:2 C. 1:4 D. ≤1:1的任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生活和生产中应用广泛。
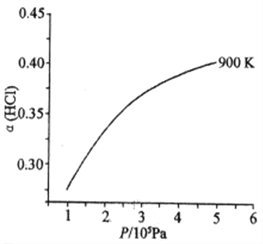
(1)已知:900 K时,4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由______________________________________。
②900 K时,体积比为4:l的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl) 随压强(P)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×l05~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图_________。
(2)已知:Cl2(g)+2NaOH(aq)==NaCl(aq)+NaClO(aq)+H2O(l) △Hl=―102 kJ·mol-1
3Cl2(g)+6NaOH(aq)==5NaCl(aq)+NaClO3(aq)+3H2O(1) △H2=―422 kJ·mol—1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式_____________________。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO―的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO―浓度为ct mol·L-1,写出该时刻溶液中Cl―浓度的表达式;c(Cl―)=_________ mol·L-1 (用c0、ct表示)
③有研究表明,生成NaClO3的反应分两步进行:
I、2ClO―=ClO2―+Cl―
II、ClO2―+ClO―=ClO3―+Cl―
常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:_______________________________。
(3)电解NaClO3水溶液可制备NaClO4。在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com