
【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
【答案】环形玻璃棒搅拌棒 保温、隔热、减少热量损失 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol 4.0 ad
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol 4.0 ad
【解析】
(1)结合仪器的结构和性能确定仪器A的名称;
(2)碎泡沫能减小空气的流通,减小能量损失;
(3)硫酸与氢氧化钠反应生成硫酸钠和水,结合中和热为57.3kJmol-1,书写热化学方程式;
(4)①先计算出每次实验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
③上述结果与57.3 kJ·mol-1有偏差,说明实验过程中有能量损失,产生此偏差,由此分析判断。
(1)为充分的搅拌,使酸碱充分混合反应,要用环形玻璃棒搅拌棒,则仪器A的名称为环形玻璃棒搅拌棒;
(2)测量过程中要尽量减少热量的损失,则碎泡沫的作用是保温、隔热、减少热量损失;
(3)中和热为57.3kJmol-1,即生成1mol水放出57.3kJ热量,则1mol硫酸与2mol氢氧化钠反应生成硫酸钠和2mol水,放出热量为114.6kJ,所以其热化学方程式:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJmol-1,中和热方程式为:![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol。
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol。
(4)①4次温度差分别为:2.5℃,4.0℃,3.9℃,4.1℃,第1组数据相差较大应舍去,其他三次温度差平均值4.0℃;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a选;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b不选;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致热量散失,中和热的数值偏小,故c不选;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d选;
故答案为:ad。


科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+O2(g)![]() 2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
A.恒容,按原平衡各物质的比例充入N2、O2和NOB.恒容,充入He
C.恒压,充入HeD.恒压,充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:

(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法正确的是
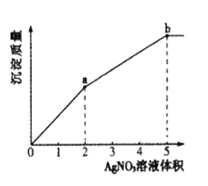
A.KSP (AgCl) < KSP (AgI)
B.c( Cl- ) :c( I-) =3:2
C.m( AgCl ) :m( AgI ) =" 2" :3
D.a~b段产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为___;
②下列能增大碳的转化率的措施是___;(填写相应字母)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
根据表中数据:
①计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
③已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,已知该溶液中各离子物质的量浓度均为
中的几种,已知该溶液中各离子物质的量浓度均为![]() 不考虑水的电离及离子的水解
不考虑水的电离及离子的水解![]() 。为确定该溶液中含有的离子,现进行了如下的操作:
。为确定该溶液中含有的离子,现进行了如下的操作:
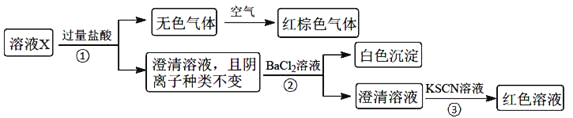
下列说法正确的是![]()
A.无色气体可能是NO和![]() 的混合物
的混合物
B.由步骤![]() 可知,原溶液肯定存在
可知,原溶液肯定存在![]()
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
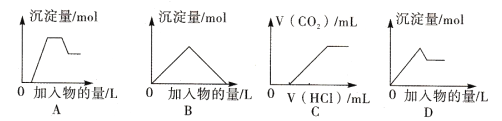
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积为1L的某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 取该溶液100mL,加入过量NaOH溶液,加热,得到
取该溶液100mL,加入过量NaOH溶液,加热,得到![]() 气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到
气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到![]() 固体;向上述滤液中加入足量
固体;向上述滤液中加入足量![]() 溶液,得到
溶液,得到![]() 不溶于盐酸的沉淀.下列叙述正确的是()
不溶于盐酸的沉淀.下列叙述正确的是()
A.溶液中的主要离子仅为![]() 、
、![]() 、
、![]()
B.![]() 一定存在,且
一定存在,且![]()
C.向原溶液中加入硫酸,可能有气体生成
D.![]() 、
、![]() 一定不存在,
一定不存在,![]() 可能存在
可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向右移动,c(H+)减小
B.加入少量CH3COONa固体,平衡向右移动
C.加入水时,平衡向右移动,CH3COOH电离常数增大
D.加入少量pH=5的硫酸,溶液中c(H+)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com