
【题目】按照无机物的分类方法,下列各组物质中,属于不同类型的物质是( )
A.火碱、烧碱、生石灰
B.生石灰、冰、干冰
C.熟石灰、苛性钠、氢氧化钾
D.纯碱、硫酸钠、胆矾
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】煤炭燃烧时产生大量SO2、NO对坏境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
ii:C0(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ/mol
CO2(g)+H2(g) △H2=-41.2kJ/mol
iii:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。甲醇还可以与乙酸反应制香料,反应为:CH3OH(l)+CH3COOH(l)![]() CH3COOCH3(l)+H2O(l)
CH3COOCH3(l)+H2O(l)
①△H3=_______制香料反应的平衡常数K 的表达式为____________。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:V正_____V逆 (填“>”、“<”或“=”)。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/mol/L | 0.2 | 0.2 | 0.4 | 0.4 |
(2)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低然煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
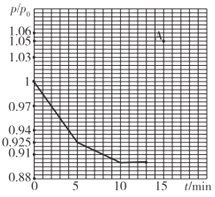
①0~5min内,该反应的平均反应速率V(N2)=______;平衡时NO的转化率为________。
②若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内p/p0的比值应在图中A点的______(填"上方”或“方”)。
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO),装置如图所示:

①阴极区的电极反应式为_________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是
A.一定条件下石墨转化为金刚石反应吸热说明石墨比金刚石稳定
B.化学反应必然伴随发生能量变化
C.化学键是一种作用力
D.不同元素组成的多原子分子中的化学键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学气敏传感器的工作原理如图所示,下列说法不正确的是
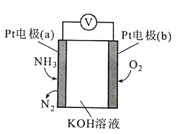
A. a极为负极
B. b极的电极反应式为O2+4e-+2H2O=4OH-
C. 电解质溶液中的OH- 移向a极
D. 该传感器工作一段时间后,电解质溶液的pH值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
①若![]() 为强碱,则
为强碱,则![]() 也为强碱
也为强碱
②若![]() 为强酸,则Y是活泼非金属元素
为强酸,则Y是活泼非金属元素
③若Y的最低化合价为-2,则Z的最高正化合价可能为+7
④若X的最高正化合价为+5,则五种元素都是非金属元素
⑤若Z的氧化物对应的水化物为HZO3,则Z的最外层电子数可能不为5
A. ②③⑤ B. ①②③ C. ②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法、英、荷三国科学家分获,以表彰他们在分子机器研究方面的成就。三蝶烯是分子机器的常见中间体,其合成方法如下:
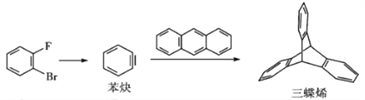
Ⅰ Ⅱ Ⅲ
下列说法正确的是
A. 化合物Ⅰ、Ⅱ、Ⅲ均为烃 B. 三蝶烯一氯取代物有3种
C. 化合物Ⅱ生成化合物Ⅲ为取代反应 D. 苯炔与苯互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,CuSO4(s)和 CuSO4·5H2O(s)溶于水及CuSO4·5H2O受热分解的能量变化如图所示,下列说法不正确的是
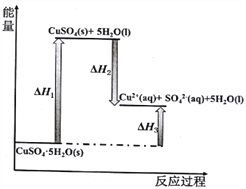
A. 将CuSO4·5H2O(s)溶于水会使溶液温度降低
B. 将CuSO4(s)溶于水会使溶液温度升高
C. △H3>△H2
D. △H1=△H2+△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,下列说法正确的是( )
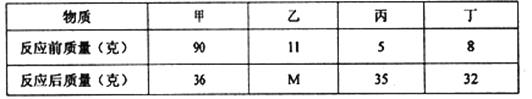
A. 该反应是化合反应 B. M的值是15
C. 反应中甲、丙质量比为15:27 D. 该反应是分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是基础化工原料,通过电解饱和食盐水可制得NaOH、H2、Cl2。完成下列填空:
(1)写出电解饱和食盐水的化学方程式________________________,阳极产物是 __________,检验该产物的一种简便化学方法是__________________________________。
(2)氯原子结构示意图为_______, 氯离子电子式是_______,氯气所含化学键是_________。
(3)氯气经过压缩后变成液氯,属于__________变化(选填“物理”或“化学”)。常用浓氨水来检查输氯管道是否破损,破损处会形成大量白烟NH4Cl和一种无色无味的单质气体,写出化学方程式并标出电子转移的方向和数目:____________________________________________。
(4)Cl与Br属于同主族元素,这两种元素非金属性较强的是______________,请用一个事实说明你的结论:____________________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com