
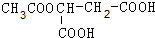 +H2O.
+H2O.
分析 (1)苹果酸与乙酸发生酯化反应生成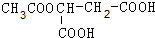 与水;
与水;
(2)对比1,3-丁二烯与苹果酸结构,整个过程引入3个官能团,则1,3-丁二烯与溴发生1,4-加成反应生成A为BrCH2CH=CHCH2Br,A发生卤代烃水解反应生成B为HOCH2CH=CHCH2OH,B发生氧化反应生成C为OHCCH=CHCHO,C进一步发生氧化反应生成D为HOOCCH=CHCOOH,D与HBr发生加成反应得到E为HOOCCHBrCH2COOH,E发生水解反应、酸化得到HOOC-CH(OH)-CH2-COOH.
解答 解:(1)苹果酸与乙酸发生酯化反应生成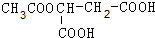 与水,反应方程式为:CH3COOH+HOOC-CH(OH)-CH2-COOH$→_{△}^{浓硫酸}$
与水,反应方程式为:CH3COOH+HOOC-CH(OH)-CH2-COOH$→_{△}^{浓硫酸}$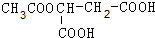 +H2O,
+H2O,
故答案为:CH3COOH+HOOC-CH(OH)-CH2-COOH$→_{△}^{浓硫酸}$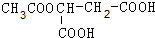 +H2O;
+H2O;
(2)对比1,3-丁二烯与苹果酸结构,整个过程引入3个官能团,则1,3-丁二烯与溴发生1,4-加成反应生成A为BrCH2CH=CHCH2Br,A发生卤代烃水解反应生成B为HOCH2CH=CHCH2OH,B发生氧化反应生成C为OHCCH=CHCHO,C进一步发生氧化反应生成D为HOOCCH=CHCOOH,D与HBr发生加成反应得到E为HOOCCHBrCH2COOH,E发生水解反应、酸化得到HOOC-CH(OH)-CH2-COOH.
1,3-丁二烯生成A的化学反应方程式是:CH2=CH-CH=CH2+Br2→BrCH2CH=CHCH2Br,
C生成D的化学反应方程式是:OHCCH=CHCHO+4Cu(OH)2$\stackrel{△}{→}$HOOCCH=CHCOOH+2Cu2O↓+4H2O,
故答案为:HOCH2CH=CHCH2OH;CH2=CH-CH=CH2+Br2→BrCH2CH=CHCH2Br;OHCCH=CHCHO+4Cu(OH)2$\stackrel{△}{→}$HOOCCH=CHCOOH+2Cu2O↓+4H2O.
点评 本题考查有机物推断与合成,结合反应条件分析官能团的衍变与引入,需要学生熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2molA+1molB | B. | 2molA+1molB+3molC+1mol D | ||
| C. | 3molC+1molD | D. | 4molA+2molB+3molC |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:
SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入盐酸 | B. | 加入NaOH(s) | C. | 加蒸馏水 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH值变化曲线 | |
| B. | b点酸的总浓度大于a点酸的总浓度 | |
| C. | a点Kw的数值比c点Kw的数值大 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com