
| m |
| M |
| n |
| V |
| n |
| V |
| 6.5g |
| 65g/mol |
| 65g |
| 6.5g |
| 2mol |
| nmol |
| 0.2mol |
| 0.2L |
| 0.1mol |
| 0.5L |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| A、1mol蔗糖可水解生成2mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
C、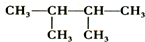 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 |
| D、乙醇可与水以任意比例混溶,是因为相似相溶原理且与水形成了氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
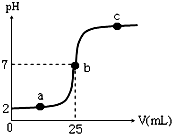 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: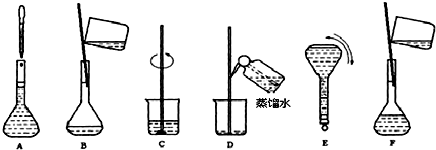
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )| A、原子半径:Y>Z>W |
| B、一定条件下,Y可置换出X |
| C、气态氢化物稳定性:Z>W |
| D、熔点YW2>XW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
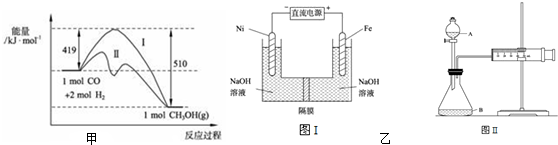
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com