
| A. | 生铁、不锈钢、青铜都属于合金 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 糖类、油脂和蛋白质都是天然高分子化合物 |
分析 A.合金是由两种或两种以上的金属与金属(或非金属)经一定方法熔合而成的具有金属特性的物质.结合各物质的成分判断;
B.同素异形体是指由同种元素组成的不同单质;
C.酸是电离出的阳离子全部是氢离子的化合物;碱是电离出的阴离子全部是氢氧根的化合物;盐是电离出的阳离子是金属离子或铵根离子、阴离子是酸根离子的化合物;
D.高分子化合物的相对分子质量特别大,一般达1万以上、一般具有重复结构单元,油脂不是高分子化合物.
解答 解:A.生铁的主要成分是铁与碳,属于合金,不锈钢是在碳素钢中加入铬、锰、钨、镍、硅、钴等合金元素,属于合金,青铜主要含有铜、锡、铅等,属于合金,故A正确;
B.14C与12C是碳元素的不同核素,不是单质,故B错误;
C.纯碱是Na2CO3,是盐不是碱,故C错误;
D.高分子化合物的相对分子质量特别大,一般达1万以上、一般具有重复结构单元,糖类中单糖、二糖,油脂不是高分子化合物,故D错误.
故选A.
点评 本题考查了合金、同素异形体、高分子化合物等知识,题目难度不大,B选项判断是否互为同素异形体是易错点,关键要把握两点:①同种元素形成,②不同单质,这是解决此类题的关键之所在.


科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | 2Q1>Q2 | D. | Q2=Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
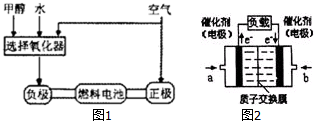
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
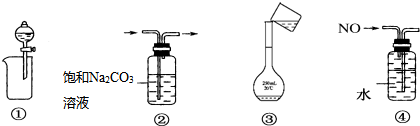
| A. | ①分离出BaSO4浊液中的BaSO4 | B. | ②除去CO2中少量HCl气体 | ||
| C. | ③将溶液转移到容量瓶中 | D. | ④排水法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂质所选用的试剂或操作方法 |
| A | Mg | Al | 加入过量盐酸溶液,充分反应,过滤 |
| B | NaHCO3溶液 | Na2CO3溶液 | 加入足量氢氧化钡溶液,充分反应,过滤 |
| C | NO | NO2 | 通过盛有水的洗气瓶,再干燥 |
| D | FeCl3溶液 | FeCl2溶液 | 加入过量的铁粉,充分反应,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
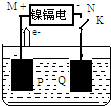 镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点.该电池充、放电时的反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.如图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是( )
镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点.该电池充、放电时的反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.如图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是( )| A. | N是镍镉电池的负极,其电极反应为Cd+2OH--2e-=Cd(OH)2 | |
| B. | 当N极有11.2gCd溶解时,P极放出气体2.24L | |
| C. | K闭合后的短时间内,N极区溶液的pH变小 | |
| D. | Q是电解池的阴极,其电极反应为Ag++e-=Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com