
【题目】铝用途广泛,用铝土矿(主要成分为Al2O3nH2O、少量SiO2和Fe2O3)制取Al有如下途径: 
(1)滤液A加过量NaOH离子方程式表示为
(2)灼烧时盛放药品的仪器名称是 .
(3)步骤Ⅳ中发生反应的化学方程式是 .
(4)步骤Ⅲ中生成固体C的离子反应方程式为 .
(5)取滤液B 100mL,加入1molL﹣1盐酸200mL,沉淀量达到最大且质量为11.7g.则滤液B中c(AlO ![]() )= , c(Na+)6molL﹣1(填“>”、“=”或“<”).
)= , c(Na+)6molL﹣1(填“>”、“=”或“<”).
【答案】
(1)4OH﹣+Al3+═AlO2﹣+2H2O、Fe3++3OH﹣═Fe(OH)3↓
(2)坩埚
(3)2Al(OH)3 ![]() Al2O3+3H2O
Al2O3+3H2O
(4)AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
(5)1.5mol?L﹣1;>
【解析】解:(1)根据以上分析,滤液A中含有Al2(SO4)3、Fe(SO4)3 , 加入过量NaOH故反应的离子方程式为4OH﹣+Al3+═AlO2﹣+2H2O、Fe3++3OH﹣═Fe(OH)3↓; 故答案:4OH﹣+Al3+═AlO2﹣+2H2O、Fe3++3OH﹣═Fe(OH)3↓;(2)根据加热溶液一般在蒸发皿里进行,而固体一般在坩埚中进行,故答案:坩埚;(3)根据以上分析,固体C为氢氧化铝,所以步骤Ⅳ中发生反应的化学方程式2Al(OH)3 ![]() Al2O3+3H2O;故答案:2Al(OH)3
Al2O3+3H2O;故答案:2Al(OH)3 ![]() Al2O3+3H2O;(4)步骤Ⅲ中生成固体C的反应是向滤液B中通入二氧化碳气体,又根据以上分析,滤液B中含有NaAlO2 , 故反应的离子方程式:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;故答案:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;(5)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO
Al2O3+3H2O;(4)步骤Ⅲ中生成固体C的反应是向滤液B中通入二氧化碳气体,又根据以上分析,滤液B中含有NaAlO2 , 故反应的离子方程式:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;故答案:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;(5)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO ![]() )=
)= ![]() =
= ![]() =1.5molL﹣1
=1.5molL﹣1
最后所得的溶液中溶质为硫酸钠、氯化钠,根据钠离子守恒有n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根守恒有n(NaCl)=n(HCl)=0.2L×1mol/L=0.2mol,n(Na2SO4)=n(H2SO4)>3n(Al2(SO4)3)=3× ![]() mol=0.45mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.45mol=1.1mol,故c(Na+)>
mol=0.45mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.45mol=1.1mol,故c(Na+)> ![]() =11mol/L,
=11mol/L,
故答案:1.5molL﹣1;>;


科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸制取乙烯,其反应式为CH3CH2OH![]() CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:

I、II、III、IV装置可以盛放的试剂有:
A、品红溶液 B、NaOH溶液
C、浓硫酸 D、酸性KMnO4溶液(试剂可以重复使用)
(1)I、II、III、IV装置中所盛的试剂分别为:_________、_________、_________、_________(填序号)
(2)使用装置II的目的是_________________。
(3)确定含有乙烯的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,下列说法不正确的是( )

A. 装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B. 甲、乙装置中的能量变化均为化学能转化为电能
C. 装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D. 装置乙中负极的电极反应式:Zn-2e-===Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-2.92 kJ·mol-1
B. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-18 kJ·mol-1
C. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-73 kJ·mol-1
D. Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝用途广泛,用铝土矿(主要成分为Al2O3nH2O、少量SiO2和Fe2O3)制取Al有如下途径: 
(1)滤液A加过量NaOH离子方程式表示为
(2)灼烧时盛放药品的仪器名称是 .
(3)步骤Ⅳ中发生反应的化学方程式是 .
(4)步骤Ⅲ中生成固体C的离子反应方程式为 .
(5)取滤液B 100mL,加入1molL﹣1盐酸200mL,沉淀量达到最大且质量为11.7g.则滤液B中c(AlO ![]() )= , c(Na+)6molL﹣1(填“>”、“=”或“<”).
)= , c(Na+)6molL﹣1(填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列实验各装置图的叙述,不正确的是( ) 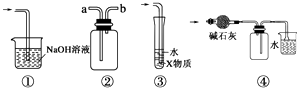
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④中可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法违反科学原理的是( )
A.碘化银可用于人工降雨
B.在一定温度、压强下,石墨可变为金刚石
C.闪电时空气中的N2可变为氮的化合物
D.烧菜时如果盐加得早,氯会挥发掉,只剩下钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com