
| m |
| M |
| 5.4g |
| 27g/mol |
| 0.2mol×3 |
| 2 |
| n |
| V |
| 0.2mol |
| 0.05L |


科目:高中化学 来源: 题型:
| A、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| B、HCl+NaOH=NaCl+H2O |
| C、Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓ |
| D、CuCl2+Fe=FeCl2+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
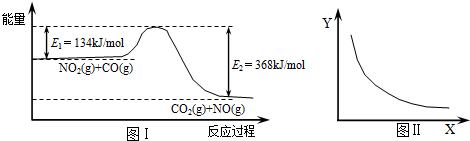
| A、该反应的焓变△H=+234 kJ?mol-1 |
| B、若X表示体系的压强,则Y表示的可能是NO2的转化率 |
| C、若X表示温度则Y表示的可能是CO2物质的量浓度 |
| D、增大CO的起始浓度,平衡向正反应方向移动,反应热增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
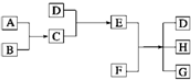 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1 Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
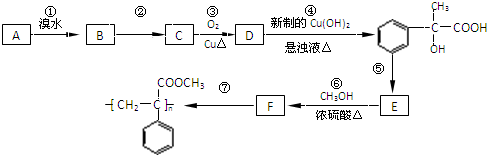
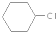 为原料合成重要的化工产品
为原料合成重要的化工产品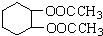 .合成路线流程图示例如下:
.合成路线流程图示例如下: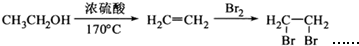 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com