
分析 典例一、(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合质量守恒定律以此配平;
(2)Cr元素的化合价降低,则K2Cr2O7为氧化剂,C元素的化合价由0升高为+4价,则C为还原剂,生成CO2是氧化产物;
(3)该反应中,硫酸中各元素的化合价不发生变化,反应中生成硫酸盐,据此分析;
(4)上述反应中C元素的化合价由0升高为+4价的CO2,则产生1molCO2气体转移电子的物质的量是4mol,据此计算;
典例二、(1)氧化剂氯气可将溴离子氧化,用过量的碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,以此写离子反应;
(2)BrCl中Cl的非金属性强,与水反应生成HCl、HBrO.
解答 典例一(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,由电子守恒可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由质量守恒定律可知,配平后的化学反应为3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O,故答案为:3;2;8;3;2;2;8;
(2)Cr元素的化合价降低,则K2Cr2O7为氧化剂,C元素的化合价由0升高为+4价,则C为还原剂,生成CO2是氧化产物,故答案为:K2Cr2O7;CO2;
(3)该反应中,硫酸中各元素的化合价不发生变化,反应中生成硫酸盐,则硫酸在该反应中作酸,体现酸性,应选A,故选A;
(4)化学反应中,1molC参加反应生成1mol二氧化碳时转移电子为1mol×(4-0)=4mol,所以若产生0.2molCO2气体,则转移电子的物质的量是0.2×4=0.8mol,故答案为:0.8;
典例二、(1)海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用过量的碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3Br2+6CO32-+3H2O═5Br-+BrO3-+6HCO3-,
故答案为:Cl2;3Br2+6CO32-+3H2O═5Br-+BrO3-+6HCO3-;
(2)BrCl中Cl的非金属性强,Cl显负电性,Br显正电性,与水反应生成HCl、HBrO,反应为BrCl+H2O═HCl+HBrO,故答案为:Br;BrCl+H2O═HCl+HBrO.
点评 本题考查氧化还原反应,明确常见元素的化合价及反应中元素的化合价变化和把握习题中的信息是解答本题的关键,侧重分析与迁移应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
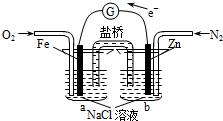
| A. | 该装置将电能转化为化学能 | B. | Fe电极发生了氧化反应 | ||
| C. | 烧杯a中的溶液pH降低 | D. | 烧杯b中发生的反应为Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅用于光导纤维 | |
| C. | SiO2不溶于水,也不溶于任何酸 | |
| D. | 用带玻璃瓶塞的试剂瓶盛放NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KH的水溶液呈碱性 | B. | KH中氢离子可以被还原为氢气 | ||
| C. | KH是一种强氧化剂 | D. | KH中的氢离子是裸露的质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe2O3是红棕色粉末 | Fe2O3常用作红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有氧化性 | SO2可使溴水褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 将该液体加热、蒸干、灼烧后,有黑色固体生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com