
| A. | 是强还原剂 | B. | 只有氧化性 | ||
| C. | 易被氧化 | D. | 其火焰都能呈现不同颜色 |
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
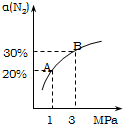 某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 保持压强不变,通入惰性气体,平衡常数不变,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯 | B. | 漏斗 | C. | 玻璃棒 | D. | 胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
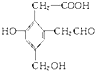 ,取足量的Na、NaOH和新制Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需 Na、NaOH和新制Cu(OH)2三种物质的物质的量之比为3:2:3.
,取足量的Na、NaOH和新制Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需 Na、NaOH和新制Cu(OH)2三种物质的物质的量之比为3:2:3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com