
【题目】硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)![]() SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
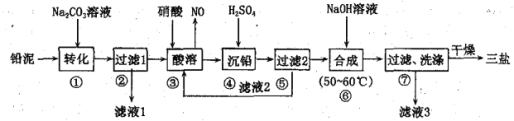
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题
(1)步骤①转化的目的是将PbSO4转化为PbCO3,反应的离子方程式为___________________。
(2)滤液3中的主要溶质为_____________(填化学式)。
(3)步骤③酸溶时,铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________________。
(4)滤液2中可循环利用的溶质为___________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)为___________mol·L-1
(5)步骤⑥合成三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.50 t,假设铅泥中的铅元素有80.00%转化为三盐,则铅泥中铅元素的质量分数为_____。[已知:三盐(3PbO·PbSO4·H2O)的相对分子质量为990,注意保留正确的有效数字]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案能达到实验目的的是
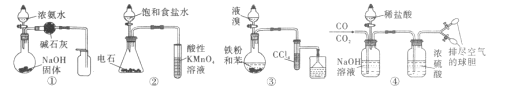
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
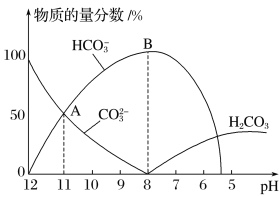
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1,X与W为同主族元素。基态R原子的M能层全充满,核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子核外价电子排布式为___。
(2)X、Y、Z三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(3)元素Y的简单气态氢化物的沸点___(填“高于”或“低于”)元素X的简单气态氢化物的沸点,其主要原因是___;元素Y的简单气态氢化物中Y原子的杂化类型为___,元素X的简单气态氢化物分子的空间构型为___。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___(填序号)。
A.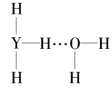 B.
B. 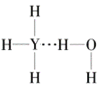 C.
C.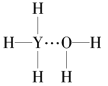 D.
D.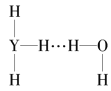
(5)R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶胞的边长是acm,则该晶体的密度为___g·cm-3(用NA表示阿伏加德罗常数的值)。
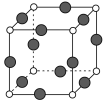
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏得到
B.C4H8Cl2的同分异构体有9种(不含立体异构)
C.苯乙烯(![]() )分子中所有原子不可能共平面
)分子中所有原子不可能共平面
D.乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
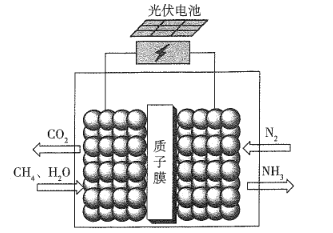
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向500 mL0.2 mol/L NaOH溶液中通入SO2气体(忽略反应过程中溶液的体积变化),设反应过程中![]() =x,已知H2SO3的电离平衡常数:Ka1=1.2×10-2,Ka2=5.6×10-8。下列说法正确的是( )
=x,已知H2SO3的电离平衡常数:Ka1=1.2×10-2,Ka2=5.6×10-8。下列说法正确的是( )
A. x=1时,c(SO32-)+c(HSO3-)=0.2 mol/L
B. x<1时,溶液可能为酸性
C. x=![]() 时,c(SO32-)+c(HSO3-)+c(OH-)=c(Na+)+c(H+)
时,c(SO32-)+c(HSO3-)+c(OH-)=c(Na+)+c(H+)
D. x<![]() 时,随通入SO2量增大,
时,随通入SO2量增大,![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com