
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ |
分析 CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大,所以c(H+)减小,Kw不变,则c(OH-)增大,据此分析.
解答 解:A.CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大的程度大,所以c(H+)减小,故A不选;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,CH3COOH溶液加水稀释过程,促进电离,氢离子物质的量增大,醋酸物质的量减小,则稀释过程中比值变大,故B选;
C.稀释过程,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw只受温度影响所以不变,故C不选;
D.稀释过程,c(H+)减小,c(OH-)增大,则$\frac{c({H}^{+})}{c(O{H}^{-})}$变小,故D不选;
故选B.
点评 本题考查了弱电解质的电离、水的离子积等,题目难度不大,注意弱电解质浓度越小电离程度越大,侧重于考查学生的分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol•L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
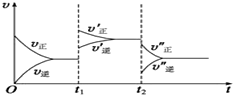 对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:
对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| B. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| C. | 加入水时,平衡向逆反应方向移动 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 石蕊试液 | ||
| C. | 含酚酞的氢氧化钠溶液 | D. | 淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 | D. | 元素非金属性:F>O>N>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com